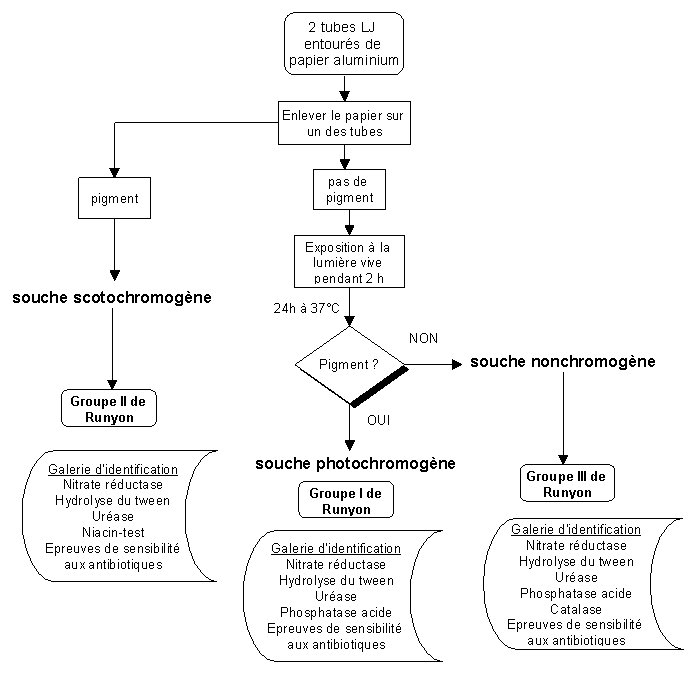
*pigmentation tardive
**M. aurum, M.
neoaurum, M. parafortuitum, ainsi que M.
thermoresistible et M. phlei qui se développent à 52°C, le premier est ß-galactosidase +, le second est ß-galactosidase -
III
- Annexes
Epreuve de photo-induction
Recherche de l'uréase
Recherche de l'activité catalasique
Recherche de l'acide nicotinique (Niacin Test de Konno)
Réduction des nitrates (Epreuve de Virtanen)
Recherche de la phosphatase acide
Recherche de l'hydrolyse du tween 80
Croissance en présence de CS (D-Cyclosérine)
Croissance en présence de EMB (Ethambutol)
Croissance en présence de Tb1 (Thiosemicarbazone)
Utilisation du mannitol comme unique source de carbone
Utilisation de l'inositol comme unique source de carbone
Utilisation du citrate de sodium comme unique source de carbone
Epreuve de photo-induction
A partir de colonies suffisamment développées, mais non vieillies (donc en phase logarithmique de croissance), un tube de Löwenstein-Jensen est exposé à la lumière (lampe de 60 watts placée à 25 cm de la culture) pendant au moins une heure. Un autre tube, habillé de papier aluminium, est observé comme témoin. Les deux tubes sont remis à l'étuve pendant 24 heures.
Si les colonies soumises
à la lumière ont pris, lors de la remise en
végétation, une pigmentation jaune,
orangée ou rouge, par rapport au témoin, la
souche est dite photochromogène.
Si la culture est
pigmentée dans les deux tubes, la souche est dite
scotochromogène.
Si aucune pigmentation
n'apparaît dans le tube entouré de papier
aluminium, ou dans le tube exposé à la
lumière, la souche est dite non
chromogène.
Remarques :
La réaction peut être compromise par l'âge de la culture (trop jeune ou tvieille), et par une insuffisance d'oxygénation (tube trop hermétique).
M. szulgai est une souche photochromogène à 25°C, scotochromogène à 37°C.
Témoins
-
Témoin souche photochromogène : culture de
M. kansasii
- Témoin souche
scotochromogène : culture de M. gordonae
Recherche de l'uréase
Réactifs
Milieu urée-indole (Sanofi Pasteur, réf. 63715)
Se conserve à +4°C.
Technique
- Introduire dans un tube à hémolyse 2 gouttes d'eau distillée stérile. Y disperser une grosse spatule de culture.
- Ajouter 1 ml de milieu urée indole.
- Fermer le tube stérilement.
- Incuber à l'étuve à 37°C pendant 3 jours.
- Après 2 heures, 1 à 3 jours d'incubation, comparer la coloration avec celle des témoins.
Réaction + = virage au rouge frambroise
Réaction - = pas de virage de couleur dans les 3 jours
Réaction ± = virage au légèrement rosé, répéter le test
Témoins
- Témoin
positif : virage au rouge framboise franc =
réaction avec culture de M. kansasii souche type.
- Témoin négatif : pas de virage de couleur = réaction sans culture.
Recherche de l'activité catalasique
Réactifs
Eau oxygénée à 30 volumes.
Tween 80, à 10 % dans l'eau.
Mélanger à parties égales au moment de l'emploi.
Technique
Activité catalasique à 22°C
- 1 ml de réactif est déposé à la surface d'une culture sur milieu de Löwenstein en position inclinée, ou en position verticale. Après 5 mn de contact, on observe:
Réaction
+ = dégagement gazeux.
Réaction -
= pas de dégagement gazeux.
Activité catalasique à 68°C (inhibition de l'activité catalasique par la chaleur).
- Faire une suspension des bactéries à étudier (culture jeune) dans 2 tubes à hémolyse : 1 anse pleine dans 2 à 3 gouttes d'eau distillée stérile.
- Porter l'un des tubes pendant 1/4 h au bain marie à 68°C.
- Laisser refroidir; ajouter dans les 2 tubes, 1 ml de réactif.
- Laisser 15 mn en contact et apprécier le dégagement gazeux.
NB : La hauteur du dégagement gazeux est proportionnelle à l'intensité de l'activité catalasique de la souche.
Recherche de l'acide nicotinique (Niacin Test de Konno)
Réactifs
Aniline pure ou PAS en poudre.
Bromure de cyanogène.
Technique
- Déposer à la surface d'une culture sur milieu de Löwenstein, 1 ml d'eau distillée stérile (si possible additionnée de 1 % de Tween 80)
- Laisser le tube incliné pendant 20 mn et recueillir l'eau dans un tube à hémolyse.
- Ajouter une goutte d'aniline ou 0,03 g de PAS en poudre; agiter.
- Laisser agir pendant 5 à 15 mn.
- Ajouter à la seringue, 1 ml de bromure de cyanogène à 10 %.
Méthode par strip (bandelette imprégnée de réactif)
- Déposer à la surface d'une culture sur milieu de Löwenstein, 1 ml d'eau distillée stérile (si possible additionnée de 1 % de Tween 80)
- Laisser le tube incliné pendant 20 mn et recueillir l'eau dans un tube à hémolyse.
- Tremper la bandelette imprégnée de réactif dans le tube à hémolyse.
- Laisser à température ambiante pendant 15 à 20 mn en agitant de temps en temps.
Niacin Test positif = Coloration jaune.
Niacin Test négatif = Incolore.
Témoins
- Témoin
positif : Coloration jaune avec culture de M.
tuberculosis.
Réduction des nitrates (Epreuve de Virtanen)
Réactifs
Solution de nitrate de sodium :
Nitrate de sodium .................................................... 0,085 g
Eau distillée.......................................................... 100 ml
Réactif A de Griess :
Acide sulfanilique................................................... 0,80 g
Acide acétique....................................................... 30 ml
Eau distillée........................................................ 100 ml
.
Réactif B de Griess :
Acide naphtylamine................................................. 0,50 g
Acide acétique...................................................... 30 ml
Eau distillée....................................................... 100 ml
Ces réactifs se conservent plusieurs mois à l'obscurité.
Technique
- Une anse de mycobactéries à étudier est émulsionnée dans 2 gouttes d'eau distillée stérile dans un tube à hémolyse.
- Ajouter 2 ml d'une solution à 0,085 % de nitrate de sodium.
- Incuber 2 h à 37°C.
- Ajouter 0,2 ml du réactif A et 0,2 ml du réactif B.
Réaction
+ = Coloration rose à rouge résultat de la réduction des nitrates en nitrites par la nitrate réductase.
Si pas de coloration,
ajouter une pincée de poudre de zinc: le zinc réduit les nitrates encore présent en nitrites, une coloration rose apparaît; la réaction est négative (bactéries sans nitrate réductase).
Si au contraire, la teinte du milieu reste inchangée, le stade nitrite a été dépassé (bactéries ayant une nitrate réductase très active).
Témoins
- Témoin
positif : culture de M. tuberculosis.
- Témoin
négatif : culture de M. bovis.
Recherche de la phosphatase acide
Réactifs
Substrat
Solution de phosphate de colamine phénol phtaléine, à 1 mg/ml dans tampon pH 5,4 (acide phénol phtaléine diphosphorique sel tétracolaminique - pour le dosage de la phosphatase - C28 H44 M4 O14 P2 MERK réf n° 24533).
Se conserve 6 semaines à +4°C.
Tampon pH = 5,4 :
ï Solution 1 = solution 0,2 M d'acide acétique, soit 6,005 g ou 5,8 ml d'acide acétique (d : 1,05) dans 500 ml d'eau distillée (acide acétique 100 % RP Normapur®. Prolabo 20.104.298).
ï Solution 2 = solution 0,2 M d'acétate de sodium, soit 13,60 g d'acétate de sodium dans 500 ml (acétate de sodium à 3 molécules d'eau. RP Normapur®. Prolabo 27.652.298).
- Ajouter 14,5 ml de la solution 1 à 85 ml de la solution 2 pour obtenir la solution tampon à pH = 5,4.
- Autoclaver 30 mn à 120°C.
- Se conserve 6 mois à +4°C.
Réactif révélateur
Carbonate de sodium en solution aqueuse à 10 % : peser 10 g, y ajouter 100 ml d'eau distillée stérile. Autoclaver 30 mn à 120°C (carbonate de sodium, Prolabo RP Normapur 27.771.290).
Se conserve 6 semaines à +4°C.
Technique
- Dans un tube à hémolyse stérile, introduire 2 gouttes d'eau distillée stérile. Y disperser une grosse spatule de la culture.
- Ajouter stérilement 0,5 ml de solution de phosphate de colamine phénol phtaléine.
- Incuber 2 heures à 37°C.
- Ajouter 0,5 ml de carbonate de sodium, observer la couleur et la comparer à celle des témoins.
Réaction + = coloration rose framboise
Réaction - = absence de coloration
Témoins
- Témoin positif =
coloration rose rouge framboise : avec culture de M.
terrae souche type
- Témoin négatif = pas de coloration : réaction sans culture.
Recherche de l'hydrolyse du tween 80
Réactifs
Bacto TB hydrolysis Reagent (Difco réf. 3192-56-5)
A conserver à l'abri de la lumière à +4°C.
Technique
- Dans un tube à hémolyse stérile ajouter 2 gouttes d'eau distillée stérile et y mettre en suspension une grosse spatule de la culture.
- Ajouter stérilement 2 ml d'eau distillée stérile puis 2 gouttes de Bacto TB hydrolysis reagent.
- Fermer le tube stérilement avec bouchon caoutchouc et incuber à l'étuve à 37°C.
- Après 1, 5 et 10 jours d'incubation : comparer la couleur du mélange à celle des témoins.
Réaction + = virage au rose rouge du liquide*
Réaction - = pas de virage de couleur du substrat.
Témoins
- Témoin négatif = pas de virage de couleur du liquide : dans un tube à hémolyse, verser stérilement 2 ml d'eau distillée et ajouter 2 gouttes de substrat.
- Témoin fortement
positif = virage au rose rouge du liquide en moins de 5 jours :
réaction avec culture de M. kansasii souche type.
*le virage au rose rouge de la culture n'indique pas que le test est positif.
Produits
Hydrazide de l'acide thiophène-2-carboxylique Sigma T-1388
Milieu de Löwenstein-Jensen non coagulé préparé extemporanément ou milieu SDP
Préparation des réactifs
Solution d'hydrazide de l'acide thiophène-2-carboxylique (TCH)
à 100 mg par ml.
- Dissoudre 10 mg de TCH dans 100 ml d'éthanol à 50%.
- Stériliser par filtration.
- Répartir la solution
par aliquots de 10 ml dans des tubes
stériles.
- Conserver à -20°C jusqu'à un an.
Milieu de Löwenstein-Jensen contenant 2 mg de TCH par ml.
- Ajouter 10 ml de solution de TCH à 100 mg par ml à 500 ml de milieu de Löwenstein-Jensen avant coagulation.
- Répartir 5 ml de milieu dans des tubes à vis
- Incliner les tubes.
- Coaguler le milieu 40 mn à 85°C.
- Conserver à 4°C pendant 3 mois.
Technique
Préparation de la
suspension bacillaire.
A partir d'une suspension bacillaire calibrée à 1 mg/ml (cf. page 6), préparer des dilutions à 10-1 et 10-3 en eau distillée stérile.
Ensemencement des tubes avec
et sans TCH.
- Inoculer 0,2 ml de la dilution 10-1 sur un tube de Löwenstein-Jensen contenant 2 mg de TCH par ml et 0,2 ml des dilutions 10-1 et 10-3 sur des tubes de Löwenstein-Jensen témoin ou ensemencer chacune des dilutions à l'anse calibrée.
- Incuber les tubes à la température optimale de croissance de la souche étudiée.
Lecture des résultats et interprétation
Examiner les tubes contenant le TCH quand la croissance est visible sur les tubes témoins.
Si la croissance sur le tube TCH est inférieure à la croissance notée sur le tube témoin ensemencé avec la dilution 10-3, la culture est notée "sensible".
Si la croissance sur le tube TCH est égale à la croissance notée sur le tube témoin ensemencé avec la dilution 10-3, la culture est notée "résistante".
La croissance sur le tube témoin ensemencé avec la dilution 10-1 doit être confluente ou présenter plus de 100 colonies. Si la numération des colonies du tube témoin est inférieure à 100, le test n'est pas interprétable.
Contrôle de qualité
Pour chaque lot de milieu de
Löwenstein-Jensen contenant du TCH, il faut
réaliser un test avec un souche de M.
tuberculosis et une souche de M. bovis.
Le milieu est de bonne
qualité si la souche de M. tuberculosis pousse et
celle de M. bovis ne pousse pas.
Si les résultats du contrôle de qualité ne sont pas satisfaisants, tous les tests réalisés avec le même lot de milieu ne sont pas interprétables.
Eliminer le lot de milieu.
Répéter le test avec un nouveau lot de milieu de Löwenstein-Jensen contenant du TCH pour chacune des souches préalablement testées.
Croissance en présence de CS (D-Cyclosérine)
Produits
D-cyclosérine Sigma C6880.
Milieu de Löwenstein-Jensen non coagulé préparé extemporanément.
Préparation des réactifs
Solution de D-cyclosérine (CS) à 3 mg par ml.
- Dissoudre 300 mg de CS dans 100 ml d'eau distillée.
- Stériliser par filtration.
- Répartir la solution
par aliquots de 5 ml dans des tubes
stériles.
- Conserver à -20°C jusqu'à un an.
Milieu de Löwenstein-Jensen contenant 30 mg de CS par ml.
- Ajouter 5 ml de solution de CS à 3 mg par ml à 500 ml de milieu de Löwenstein-Jensen avant coagulation.
- Répartir 5 ml de milieu dans des tubes à vis
- Incliner les tubes.
- Coaguler le milieu 40 mn à 85°C.
- Conserver à 4°C pendant 3 mois.
Technique
Préparation de la
suspension bacillaire.
A partir d'une suspension
bacillaire calibrée au 1 mg/ml (cf page 6),
préparer des dilutions à 10-1 et
10-3 en eau distillée stérile.
Ensemencement des tubes avec et sans CS.
- Inoculer 0,2 ml de la dilution 10-1 sur un tube de Löwenstein-Jensen contenant 30 mg de CS par ml et 0,2 ml des dilutions 10-1 et 10-3 sur des tubes de Löwenstein-Jensen témoin ou ensemencer chacune des dilutions à l'anse calibrée.
- Incuber les tubes à la température optimale de croissance de la souche étudiée.
Lecture des résultats et interprétation
Examiner les tubes avec CS quand la croissance est visible sur les tubes témoins.
Si la croissance sur le tube CS est inférieure à la croissance notée sur le tube témoin ensemencé avec la dilution 10-3, la culture est notée "sensible".
Si la croissance sur le tube CS est égale à la croissance notée sur le tube témoin ensemencé avec la dilution 10-3, la culture est notée "résistante".
La croissance sur le tube témoin ensemencé avec la dilution 10-1 doit être confluente ou présenter plus de 100 colonies. Si la numération des colonies du tube témoin est inférieure à 100, le test n'est pas interprétable.
Contrôle de qualité
Pour chaque lot de milieu de
Löwenstein-Jensen avec CS, il faut réaliser un test
avec un souche de M. fortuitum et une souche de M.
smegmatis.
Le milieu est de bonne
qualité si la souche de M. fortuitum est
résistante et celle de M. smegmatis est sensible.
Si les résultats du contrôle de qualité ne sont pas satisfaisants, tous les tests réalisés avec le même lot de milieu ne sont pas interprétables.
Eliminer le lot de milieu.
Répéter le test avec un nouveau lot de milieu de Löwenstein-Jensen avec la Cyclosérine pour chacune des souches préalablement testées.
Croissance en présence de EMB (Ethambutol)
Produits
Ethambutol Sigma E-4630
Milieu de Löwenstein-Jensen non coagulé préparé extemporanément.
Préparation des réactifs
Solution d'éthambutol (EMB) à 0,1 mg par ml.
- Dissoudre 10 mg de EMB dans 100 ml d'eau distillée.
- Stériliser par filtration.
- Répartir la solution
par aliquots de 10 ml dans des tubes
stériles.
- Conserver à -20°C jusqu'à un an.
Milieu de Löwenstein-Jensen contenant 2 mg de EMB par ml.
- Ajouter 10 ml de solution de EMB à 0,1 mg par ml à 500 ml de milieu de Löwenstein-Jensen avant coagulation.
- Répartir 5 ml de milieu dans des tubes à vis
- Incliner les tubes.
- Coaguler le milieu 40 mn à 85°C.
- Conserver à 4°C pendant 3 mois.
Technique
Préparation de la
suspension bacillaire.
A partir d'une suspension bacillaire calibrée à 1 mg /ml
(cf. page 6), préparer des dilutions à 10-1 et 10-3 en eau distillée stérile.
Ensemencement des tubes avec et sans EMB.
Inoculer 0,2 ml de la dilution 10-1 sur un tube de Löwenstein-Jensen contenant 2 mg de EMB par ml et 0,2 ml des dilutions 10-1 et 10-3 sur des tubes de Löwenstein-Jensen témoin ou ensemencer chacune des dilutions à l'anse calibrée.
Incuber les tubes à la température optimale de croissance de la souche étudiée.
Lecture des résultats et interprétation
Examiner les tubes avec EMB quand la croissance est visible sur les tubes témoins.
Si la croissance sur le tube EMB est inférieure à la croissance notée sur le tube témoin ensemencé avec la dilution 10-3, la culture est notée "sensible".
Si la croissance sur le tube EMB est égale à la croissance notée sur le tube témoin ensemencé avec la dilution 10-3, la culture est notée "résistante".
La croissance sur le tube témoin ensemencé avec la dilution 10-1 doit être confluente ou présenter plus de 100 colonies. Si la numération des colonies du tube témoin est inférieure à 100, le test n'est pas interprétable.
Contrôle de qualité
Pour chaque lot de milieu de
Löwenstein-Jensen avec EMB, il faut réaliser un
test avec un souche de M. fortuitum et une souche de
M. smegmatis.
Le milieu est de bonne
qualité si la souche de M. fortuitum est
résistante et celle de M. smegmatis est sensible.
Si les résultats du contrôle de qualité ne sont pas satisfaisants, tous les tests réalisés avec le même lot de milieu ne sont pas interprétables.
Eliminer le lot de milieu.
Répéter le test avec un nouveau lot de milieu de Löwenstein-Jensen avec EMB pour chacune des souches préalablement testées.
Croissance en présence de Tb1 (Thiosemicarbazone)
Produits
Thiosemicarbazone Sigma T8900
Milieu de Löwenstein-Jensen non coagulé préparé extemporanément.
Préparation des réactifs
Solution de
thiosemicarbazone (Tb1) à 1 mg par ml.
- Dissoudre 100 mg de Tb1 dans 100 ml de diméthyl sulfoxide.
- Stériliser par filtration.
- Répartir la solution
par aliquots de 5 ml dans des tubes
stériles.
- Conserver à -20°C jusqu'à un an.
Milieu de Löwenstein-Jensen contenant 10 mg de Tb1 par ml.
- Ajouter 5 ml de solution de Tb1 à 1 mg par ml à 500 ml de milieu de Löwenstein-Jensen avant coagulation.
- Répartir 5 ml de milieu dans des tubes à vis
- Incliner les tubes.
- Coaguler le milieu 40 mn à 85°C.
- - Conserver à 4°C pendant 3 mois.
Technique
Préparation de la
suspension bacillaire.
- A partir d'une suspension bacillaire calibrée au 1mg/ml (cf. page 6), préparer des dilutions à 10-1 et 10-3 en eau distillée stérile.
Ensemencement des tubes avec
et sans Tb1.
- Inoculer 0,2 ml de la dilution 10-1 sur un tube de Löwenstein-Jensen contenant 10 mg de Tb1 par ml et 0,2 ml des dilutions 10-1 et 10-3 sur des tubes de Löwenstein-Jensen témoin ou ensemencer chacune des dilutions à l'anse calibrée.
- Incuber les tubes à la température optimale de croissance de la souche étudiée.
Lecture des résultats et interprétation
Examiner les tubes avec Tb1 quand la croissance est visible sur les tubes témoins.
Si la croissance sur le tube Tb1 est inférieure à la croissance notée sur le tube témoin ensemencé avec la dilution 10-3, la culture est notée "sensible".
Si la croissance sur le tube Tb1 est égale à la croissance notée sur le tube témoin ensemencé avec la dilution 10-3, la culture est notée "résistante".
La croissance sur le tube témoin ensemencé avec la dilution 10-1 doit être confluente ou présenter plus de 100 colonies. Si la numération des colonies du tube témoin est inférieure à 100, le test n'est pas interprétable.
Contrôle de qualité
Pour chaque lot de milieu de
Löwenstein-Jensen avec Tb1, il faut réaliser un
test avec un souche de M. fortuitum et une souche de
M. smegmatis.
Le milieu est de bonne
qualité si la souche de M. fortuitum est
résistante et celle de M. smegmatis est sensible.
Si les résultats du contrôle de qualité ne sont pas satisfaisants, tous les tests réalisés avec le même lot de milieu ne sont pas interprétables.
Eliminer le lot de milieu.
Répéter le test avec un nouveau lot de milieu de Löwenstein-Jensen avec Tb1 pour chacune des souches préalablement testées.
Utilisation du mannitol comme unique source de carbone
Produits
Mannitol Prolabo 25313.237
Sulfate d'ammonium
(NH4)2SO4
Phosphate monopotassique
KH2PO4
Sulfate de magnésium
MgSO4, 7H2O
Gélose purifiée.
Préparation des réactifs
Solution de mannitol à 10%.
- Dissoudre 5 g de mannitol dans 50 ml d'eau distillée.
- Stériliser par filtration.
Milieu de base.
- Peser 2, 4 g de sulfate
d'ammonium (NH4)2SO4
- Peser 0,5 g de phosphate
monopotassique KH2PO4
- Peser 0,5 g de sulfate de
magnésium MgSO4, 7H2O
- Dissoudre les sels dans 950 ml d'eau distillée.
- Ajuster le pH à 7,2.
- Ajouter 20 g de gélose purifiée.
- Autoclaver à 121°C pendant 20 mn.
Milieu Mannitol.
- Préchauffer le milieu de base à 56°C dans un bain-marie.
- Ajouter stérilement 25 ml de solution de mannitol à 475 ml de milieu de base.
- Répartir stérilement 5 ml de milieu dans des tubes à vis.
- Incliner les tubes et laisser solidifier le milieu.
- Conserver à 4°C pendant 3 mois.
Milieu témoin.
- Préchauffer le milieu de base à 56°C dans un bain-marie.
- Répartir stérilement 5 ml de milieu de base dans des tubes à vis
- Répartir ainsi 450 ml de milieu de base.
- Incliner les tubes et laisser solidifier le milieu.
- Conserver à 4°C pendant 3 mois.
Technique
- Inoculer un tube de milieu de base et un tube de milieu de culture avec 0,2 ml de la dilution 10-3 de la suspension de culture calibrée au 1 mg/ml
(cf page 6).
- Incuber les tubes à la température optimale de croissance de la souche.
- Inoculer un tube de milieu de culture avec 0,2 ml de la dilution
10-3 d'une suspension
de M. peregrinum calibrée au 1mg/ml (cf page 6).
- Incuber le tube à 37°C.
Lecture des résultats et interprétation
Quand la croissance est visible
sur le tube ensemencé avec la suspension de M.
peregrinum, examiner la croissance sur les tubes de milieu de base et de milieu de culture ensemencés avec la souche à étudier.
Si une croissance est visible sur le milieu de culture et en l'absence de croissance sur le milieu de base, le test est positif.
En l'absence de croissance sur les 2 tubes, de milieu de base et de milieu de culture, le test est négatif.
Si une croissance est visible sur le milieu de base, répéter le test.
Contrôle de qualité
Le tube de milieu de culture
ensemencé avec la souche de M. peregrinum constitue le contrôle positif.
Le tube de milieu de base ensemencé avec la souche à étudier constitue le contrôle négatif.
Si aucune croissance
n'est visible sur le tube de milieu de culture
ensemencé avec M. peregrinum, jeter le lot de milieu. Répéter le test sur un nouveau lot.
Si une croissance est visible sur le milieu de base, répéter le test avec une dilution à 10-3 de la suspension au mg de la souche à étudier.
Utilisation de l'inositol comme unique source de carbone
Produits
Inositol Prolabo 24746.236
Sulfate d'ammonium
(NH4)2SO4
Phosphate monopotassique
KH2PO4
Sulfate de magnésium
MgSO4, 7H2O
Gélose purifiée.
Préparation des réactifs et conservation
Solution d'inositol à 10%.
- Dissoudre 5 g d'inositol dans 50 ml d'eau distillée.
- Stériliser par filtration.
Milieu de base.
- Peser 2, 4 g de sulfate
d'ammonium (NH4)2SO4
- Peser 0,5 g de phosphate
monopotassique KH2PO4
- Peser 0,5 g de sulfate de
magnésium MgSO4, 7H2O
- Dissoudre les sels dans 950 ml d'eau distillée.
- Ajuster le pH à 7,2.
- Ajouter 20 g de gélose purifiée.
- Autoclaver à 121°C pendant 20 mn.
Milieu
Inositol.
- Préchauffer le milieu de base à 56°C dans un bain-marie.
- Ajouter stérilement 25 ml de solution d'inositol à 475 ml de milieu de base.
- Répartir stérilement 5 ml de milieu dans des tubes à vis
- Incliner les tubes et laisser solidifier le milieu.
- Conserver à 4°C pendant 3 mois.
Milieu témoin.
- Préchauffer le milieu de base à 56°C dans un bain-marie.
- Répartir stérilement 5 ml de milieu de base dans des tubes à vis
- Répartir ainsi 450 ml de milieu de base.
- Incliner les tubes et laisser solidifier le milieu.
- Conserver à 4°C pendant 3 mois.
Technique
- Inoculer un tube de milieu de base et un tube de milieu de culture avec 0,2 ml de la dilution 10-3 de la suspension de culture calibrée au 1mg /ml
(cf page 6).
- Incuber les tubes à la température optimale de croissance de la souche.
- Inoculer un tube de milieu de culture avec 0,2 ml de la dilution
10-3 d'une suspension
de M. peregrinum calibrée au mg (cf page 6).
- Incuber le tube à 37°C.
Lecture des résultats et interprétation
Quand la croissance est visible
sur le tube ensemencé avec la suspension de M.
peregrinum, examiner la croissance sur les tubes de milieu de base et de milieu de culture ensemencés avec la souche à étudier.
Si une croissance est visible sur le milieu de culture et en l'absence de croissance sur le milieu de base, le test est positif.
En l'absence de croissance sur les 2 tubes, de milieu de base et de milieu de culture, le test est négatif.
Si une croissance est visible sur le milieu de base, répéter le test.
Contrôle de qualité
Le tube de milieu de culture
ensemencé avec la souche de M. peregrinum constitue le contrôle positif.
Le tube de milieu de base ensemencé avec la souche à étudier constitue le contrôle négatif.
Si aucune croissance
n'est visible sur le tube de milieu de culture
ensemencé avec M. peregrinum, jeter le lot de milieu. Répéter le test sur un nouveau lot.
Si une croissance est visible sur le milieu de base, répéter le test avec une dilution à 10-3 de la suspension au mg de la souche à étudier.
Utilisation du citrate de sodium comme unique source de carbone
Produits
Citrate trisodique Prolabo 27833.294
Sulfate d'ammonium
(NH4)2SO4
Phosphate monopotassique
KH2PO4
Sulfate de magnésium
MgSO4, 7H2O
Gélose purifiée.
Préparation des réactifs
Solution de citrate de sodium.
- Dissoudre 5,6 g de citrate de sodium dans 50 ml d'eau distillée.
- Stériliser par filtration.
Milieu de base.
- Peser 2, 4 g de sulfate
d'ammonium (NH4)2SO4
- Peser 0,5 g de phosphate
monopotassique KH2PO4
- Peser 0,5 g de sulfate de
magnésium MgSO4, 7H2O
- Dissoudre les sels dans 950 ml d'eau distillée.
- Ajuster le pH à 7.
- Ajouter 20 g de gélose purifiée.
- Autoclaver à 121°C pendant 20 mn.
Milieu témoin.
- Préchauffer le milieu de base à 56°C dans un bain-marie.
- Répartir stérilement 5 ml de milieu de base dans des tubes à vis
- Répartir ainsi 450 ml de milieu de base
- Incliner les tubes et laisser solidifier le milieu.
- Conserver à 4°C pendant 3 mois.
Milieu de culture.
- Préchauffer le milieu de base à 56°C dans un bain-marie.
- Ajouter stérilement 25 ml de solution de citrate de sodium à 475 ml de milieu de base.
- Répartir stérilement 5 ml de milieu dans des tubes à vis
- Incliner les tubes et laisser solidifier le milieu.
- Conserver à 4°C pendant 3 mois.
Technique
- Inoculer un tube de milieu de base et un tube de milieu de culture avec 0,2 ml de la dilution 10-3 de la suspension de culture calibrée au 1 mg/ml (cf.page 6).
- Incuber les tubes à la température optimale de croissance de la souche.
- Inoculer un tube de milieu de culture avec 0,2 ml de la dilution
10-3
d'une suspension de M. chelonei calibrée au 1 mg /ml (cf.page 6).
- Incuber le tube à 37°C.
Lecture des résultats et interprétation
Quand la croissance est visible
sur le tube ensemencé avec la suspension de M.
chelonei, examiner la croissance sur les tubes de milieu de base et de milieu de culture ensemencés avec la souche à étudier.
Si une croissance est visible sur le milieu de culture et en l'absence de croissance sur le milieu de base, le test est positif.
En l'absence de croissance sur les 2 tubes, de milieu de base et de milieu de culture, le test est négatif.
Si une croissance est visible sur le milieu de base, répéter le test.
Contrôle de qualité
Le tube de milieu de culture
ensemencé avec la souche de M. chelonei constitue le contrôle positif.
Le tube de milieu de base ensemencé avec la souche à étudier constitue le contrôle négatif.
Si aucune croissance
n'est visible sur le tube de milieu de culture
ensemencé avec M. chelonei, jeter le lot de milieu. Répéter le test sur un nouveau lot.
Si une croissance est visible sur le milieu de base, répéter le test avec une dilution à 10-3 de la suspension au mg de la souche à étudier.