|
Azay - Mycobactéries |
Culture des mycobactéries |
MO-MYC-003 |
P 1/22 |
|
|
|
|
|
|
|
|
|
|
I - ObjetII - Réactifs
III - Méthodologie
A - Culture en milieu solideC - Culture en milieu diphasique : BBL Septi-Check AFBTM
D - Hémocultures
IV - Annexes
A - Culture en milieu solide1 - Milieux prêts à l'emploiC - Culture en milieu diphasique
D - Hémocultures
Rédigé par:
Date:
Signature
Vérifié par :
Date :
Signature
Approuvé par:
Pour application le
Signature
Ce document a pour objet de détailler les modalités de la mise en culture des mycobactéries et l'interprétation des résultats de la culture.
Les modalités de la préparation des milieux de culture et des réactifs pour chacune des méthodes décrites se trouvent en annexe du document.
A - Culture en milieu solideC - Culture en milieu diphasique : BBL Septi-Check AFBTM
D - Hémocultures
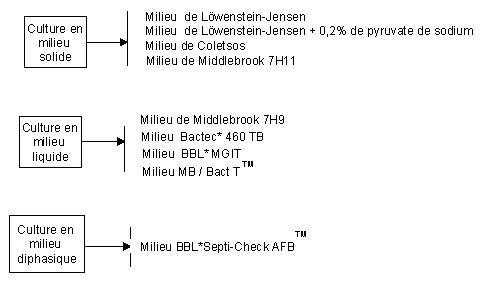
Trois modalités de culture des mycobactéries peuvent être utilisées

.
A - Culture en milieu solide1 - Ensemencement classiqueSelon la nomenclature, l'ensemencement doit être fait au moins sur 4 tubes. En pratique, on utilisera 2 tubes de milieux de Löwenstein-Jensen et 2 tubes de milieu enrichi : 1 tube de milieu Coletsos et 1 tube de milieu de Löwenstein-Jensen enrichi avec 0,2% de pyruvate.
Inoculer 0,2 ml de culot de prélèvement par tube.
Incuber les tubes non vissés, en position inclinée à 37°C. Surveiller régulièrement l'évaporation de liquide (3-6 jours) avant de revisser les tubes.
2 - Observation des cultures
La lecture est faite 1 fois par semaine. Eliminer les tubes contaminés et noter la nature des contaminants.Si tous les tubes sont contaminés, refaire si possible une deuxième décontamination soit à partir du prélèvement initial, soit à partir du du culot. Sinon demander un nouveau prélèvement.
Garder les tubes de culture au moins 8 semaines à l'étuve à 37°C avant de considérer la culture comme négative.
Réaliser l'identification des cultures positives (MO-MYC-005).
3 - Conditions particulières de culture
Ensemencer des tubes de Löwenstein-Jensen complémentaires :
. A différentes températures d'incubation:- à 30°C pour les lésions cutanées (M. marinum, M. ulcerans)
- à 42°C en cas de suspicion d'infection à M. xenopi
. Enrichis pour les mycobactéries de croissance difficile
- Milieu de Löwenstein-Jensen enrichi avec du citrate de fer ammoniacal ou milieu au sang cuit + Polyvitex® pour M. haemophilum incubé en atmosphère de CO2 à 30-32°C.
- Milieu de Löwenstein-Jensen enrichi en mycobactine pour isoler certains M. avium déficients.
- Ensemencer un milieu liquide pour la recherche de M. genavense.
1 - Technique radiométrique Bactec ® 460 TB (Becton Dickinson)
3 - Système MB/BacT TM (Organon Teknika)
1 - Technique radiométrique Bactec ® 460 TB (Becton Dickinson)a - Principe
La méthode de respirométrie radiométrique Bactec consiste à apprécier la croissance des mycobactéries en mesurant la quantité de 14CO2 libérée par le métabolisme de l'acide palmitique marqué au 14C présent dans le milieu de culture 7H12. L'appareil Bactec® permet de mesurer la quantité de 14CO2 dans l'atmosphère gazeuse du flacon et de l'exprimer selon une graduation appelée GI (Growth Index) allant de 0 (absence de 14CO2) à 999 correspondant à la quantité maximale de croissance décelable par l'automate.
b - Technique
Toutes les inoculations dans le flacon 12B sont faites à la seringue à insuline (Plastipak 1 ml Sub-Q, Becton Dickinson réf. 305501).
Avant et après chaque manipulation, les opercules des flacons sont décontaminés avec un désinfectant mycobactéricide (cf. PR-HS-001).
Préparation des flacons
Avant l'ensemencement, l'atmosphère des flacons 12B doit être standardisée par administration d'un mélange gazeux convenable.
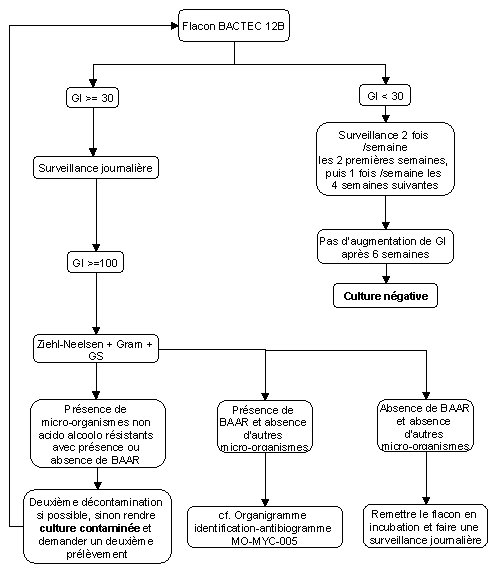
Ceci peut-être effectué une fois par semaine pour les flacons qui seraient utilisés pendant la semaine. Tout flacon donnant un index de croissance supérieur ou égal à 20 ne devra pas être utilisé.
1 - Prélèvements ayant subi une décontamination :
Il s'agit de prélèvements initialement contaminés pour lesquels on complète l'effet de la décontamination en réalisant la culture en présence d'un mélange antibiotique susceptible d'inhiber la croissance des bactéries indésirables, sans perturber la culture des mycobactéries.
Reconstituer le supplément PANTA avec 5 ml de solution de reconstitution (PRF). Il est possible d'ajouter à ce supplément de la Vancomycine (Lilly) à une concentration finale variable de 1 à 4 mg/ml selon les sites (PANTAV).
Après reconstitution, ce supplément peut-être conservé à + 4°C au maximum pendant une semaine.
Ajouter 0,1 ml de ce mélange PANTA ou PANTAV à chaque flacon 12B avant l'ensemencement. Ce supplément peut-être ajouté 2 à 3 jours à l'avance à condition que les flacons soient conservés à + 4°C.
2- Prélèvements non contaminés :
Les prélèvements aseptiques doivent être ensemencés sans décontamination préalable directement en milieu 12B sans addition de PANTA. Il est nécessaire d'ajouter 0,1 ml de PRF seul (solution de reconstitution du PANTA) qui contient du stéarate de polyoxyéthylène (POES) pour favoriser la croissance des mycobactéries.
Ensemencement des flacons
Ensemencer 0,5 ml de culot de prélèvement (voir MO-MYC-002). Il est recommandé d'ensemencer en parallèle un milieu de Löwenstein-Jensen avec 0,2 ml de culot de prélèvement.
Observation des cultures
La lecture des flacons se fait sur l'appareil Bactec 460 TB 2 fois par semaine pendant les deux premières semaines puis 1 fois par semaine jusqu'à la fin de la 6ème semaine.
Remarques :
Pour les prélèvements à frottis négatifs, la lecture peut être faite qu'une fois par semaine la première semaine. Pour les prélèvements à frottis très positifs (3+ à 4+), il est conseillé de faire la lecture tous les jours dès le lendemain de l'ensemencement.
Un index de croissance GI supérieur ou égal à 30 est considéré comme potentiellement positif, et sera suivi par des lectures quotidiennes.
Une augmentation rapide de l'index de croissance ou de la turbidité doit faire suspecter une contamination. On confirmera celle-ci par la réalisation d'une double coloration de gram et de Ziehl Neelsen. Une deuxième décontamination peut être envisagée à partir du prélèvement initial conservé à + 4°C ou à défaut après centrifugation du milieu contaminé et décontamination du culot (MO-MYC-002). Enfin, un nouveau prélèvement peut être demandé.
Quand l'index de croissance est supérieur ou égal à 100 faire un frottis et colorer par la méthode de Ziehl-Neelsen. Observer la présence de bacilles acido-alcoolo résistants et leurs caractéristiques morphologiques (cordes, échelles, etc...) pour orienter l'identification (voir MO-MYC-005).
Faire l'identification immédiate des cultures positives à l'aide de sondes nucléiques avant d'informer le clinicien.
S'il n'y a pas d'augmentation d'index de croissance au bout de 6 semaines d'incubation, rendre la culture négative.
2 - Technique de fluorescence manuelle : BBL ® MGIT (Mycobacteria Growth Indicator Tube - Becton Dickinson)
a - PrincipeCette méthode utilise un milieu 7H9 contenant un sel de Ruthénium. Cette susbstance émet une fluorescence d'autant plus vive que la pression partielle d'oxygène est plus faible. Le métabolisme microbien provoque une déplétion en oxygène et entraîne l'apparition d'une fluorescence dont l'intensité est proportionnelle au niveau de réduction du milieu.
b - Technique
Préparation des tubes
Reconstituer l'ampoule de supplément PANTA avec 3 ml d'eau distillée stérile. Cette solution peut-être aliquotée et congelée à -20°C pour conservation.
Dévisser le tube MGIT et ajouter de manière aseptique:
- 0,1 ml de PANTA reconstitué (voir page 5/21).
- 0,5 ml de MGIT-OADC.
Ensemencement
Ensemencer à la pipette 0,5 ml de culot de prélèvement (MO-MYC-002)
Fermer le tube et homogénéiser au vortex.
Incuber à 37°C pendant 8 semaines.
Il est recommandé d'ensemencer en parallèle un milieu Löwenstein Jensen avec 0,2 ml de culot de prélèvement.
Observation des cultures
Préparation du témoin positif :
Vider le bouillon d'un tube MGIT. Préparer une solution de sulfite de sodium à 0,4% (0,4 g dans 100 ml d'eau distillée).
Mettre 5 ml de la solution de sulfite de sodium dans le tube et laisser reposer 1 heure avant de l'utiliser. Ce témoin positif conservé à température ambiante ne pourra être utilisé au delà de 4 semaines. Le témoin négatif est réalisé par un tube MGIT non ensemencé.
NB : Le témoin positif peut être également préparé en ensemençant un tube MGIT avec un bacille à Gram négatif, type E. coli.
Lecture des tubes:
Le tube MGIT doit être retiré du support et comparé aux tubes témoins.
Placer les tubes sous la lampe UV entre un tube témoin positif et un tube témoin négatif. Eviter de lire les tubes dans une pièce ensoleillée ou sous une lumière vive.
Rechercher les tubes MGIT émettant une fluorescence. La fluorescence se caractérise par une couleur orange vif dans le fond du tube et une réflexion orange sur le ménisque de la surface. Si la fluorescence du tube MGIT se rapproche de celle du tube témoin positif, la culture est positive. Si elle se rapproche de celle du tube témoin négatif, la culture est négative.
La croissance peut aussi être détectée par la présence d'une turbidité homogène ou non, de petits grains ou de flocons dans le milieu de culture.
Une coloration de Ziehl-Neelsen doit être faite sur les cultures positives pour contrôler la présence de bacilles acido-alcoolo résistants. En cas de frottis négatif, rechercher une éventuelle contamination bactérienne par une coloration de Gram.
Il faut rechercher l'apparition d'une fluorescence des tubes pendant huit semaines avant de déclarer les cultures négatives et de vérifier l'éventuelle présence d'une turbidité ou de petits grains avant de les éliminer.
3 - Système MB/BacT TM (Organon Teknika)
a - Principe
Le système MB/BacT utilise une méthode de détection qui en permanence évalue dans le flacon de culture, l'évolution de la croissance microbienne en mesurant grâce à un indicateur coloré convenable, la quantité de CO2 élaboré. Le système de lecture complété d'un équipement informatique sophistiqué compare les mesures obtenues à un système algorithmique de référence et déclenche le signal de positivité quand la variation des différents paramètres est suffisante.
b - Technique
Toutes les manipulations sont faites à la seringue à insuline (type Plastipak 1 ml Sub-Q, Becton Dickinson réf. 305501).
Avant chaque manipulation, l'opercule des flacons est décontaminé avec un désinfectant mycobactéricide (ex: Hexanios de la Société ANIOS).
Préparation des flacons
1- Préparer le complément d'antibiotiques :Ajouter aseptiquement 10 ml de solution de reconstitution dans chaque flacon de complément d'antibiotiques MB/Bact.
Le complément d'antibiotiques peut être conservé 7 jours entre +2° et +8°C.
2 - Prélèvements ayant subi une décontamination :
Avant l'inoculation ajouter aseptiquement dans chaque flacon 0,5 ml de complément d'antibiotiques reconstitué.
3 - Prélèvements non contaminés :
Avant l'inoculation ajouter aseptiquement dans chaque flacon 0,5 ml de solution de reconstitution.
Une coloration rose du milieu indique que le complément ou la solution de reconstitution ont été ajoutés correctement.
Ensemencement des flaconsEnsemencer aseptiquement 0,5 ml de culot (MO-MYC-002).
Il est recommandé de procéder parallèlement à l'inoculation d'un tube de Löwenstein-Jensen.
Incuber à 37°C pendant 8 semaines.
Observation des cultures
Introduire les flacons MB/Bact T inoculés dans le MB/Bact T selon les instructions figurant dans le manuel d'utilisation.
Sur les flacons jugés positifs, faire la coloration de Ziehl-Neelsen pour observer la présence de bacilles acido-alcoolo résistants et suivre la procédure habituelle d'identification.
Si la coloration de Gram révèle la présence d'autres germes que des mycobactéries demander, si possible, un nouveau prélèvement , sinon la totalité du contenu du flacon peut être soumise après centrifugation à une nouvelle décontamination (cf. MO-MYC-002).
Après 42 jours de séjour dans l'appareil, tout flacon qui ne montre aucun trouble ni aucune manifestation de culture est déclaré négatif. Si le contenu du flacon est trouble, prélever un échantillon pour repiquage et subculture.
4 - Conditions particulières de culture
Ensemencer un flacon complémentaire et l'incuber:
- à 30°C pour les lésions cutanées (M. marinum, M. ulcerans)- à 42°C en cas de suspicion d'infection à M. xenopi
C - Culture en milieu diphasique : BBL Septi-Check AFBTM
a - PrincipeLe dispositif MB Check est un ensemble diphasique qui associe un flacon contenant le milieu liquide 7H9 et un système prismatique contenu dans un tube qui se visse sur le flacon. Les faces du prisme sont recouvertes respectivement de milieu de Löwenstein-Jensen, de milieu 7H11 et de gélose au sang cuit.
Le culot de prélèvement est inoculé dans la phase liquide et, à intervalles réguliers, le flacon est retourné, ce qui permet l'ensemencement des faces du prisme avec le milieu liquide.
b - Technique
. Reconstitution du supplément pour culture de mycobactéries
Reprendre le lyophilisat par 9 ml d'eau distillée stérile.
Une fois dissout, le supplément peut être conservé à l'abri de la lumière pendant 2 semaines entre +2°C et +8°C ou à - 20°C.
. Préparation des flacons
Ajouter 1 ml de supplément reconstitué à chaque flacon de milieu de base avant ensemencement.
Les flacons ainsi préparés peuvent être conservés à l'abri de la lumière pendant 2 semaines entre +2 et +8°C.
. Ensemencement des flacons
Ensemencer 1 ml de culot de prélèvement (voir fiche technique de préparation des échantillons). Mélanger.
Mettre en place le prisme contenant les 3 phases solides sur le flacon. Retourner le flacon pour ensemencer le prisme.
Incuber en position verticale à 37°C.
. Observation des cultures
Lecture quotidienne des flacons (bouillon + prisme) la première semaine pour détecter les mycobactéries à croissance rapide ou les contaminants éventuels.
Au delà de la 1ère semaine, lecture hebdomadaire pendant 3 mois. A chaque lecture, retourner le flacon pour ensemencer le prisme.
Un trouble dans le flacon ou des colonies sur le prisme sont des indicateurs de positivité. Faire une coloration de Ziehl-Neelsen et suivre les procédures habituelles d'identification (MO-MYC-005).
Deux techniques sont utilisées pour rechercher les mycobactéries dans les prélèvements sanguins.2 - Technique radiométrique Bactec ® 460 TB (Becton Dickinson)
3 - Technique de fluorescence Bactec® 9240 (Becton Dickinson)
. EnsemencementPrélever 10 ml de sang au lit du malade sur tube Isolator et retourner le tube à plusieurs reprises pour initier la lyse des cellules.
Après centrifugation de 30 mn à 3000 g, désinfecter le bouchon et poser le capuchon de prélèvement à la presse Isostat®.
Aspirer et éliminer le surnageant avec la pipette Isolator pour surnageant.
Homogénéiser le culot au vortex. Prélever la totalité du culot à la pipette Isolator pour culot de centrifugation.
Mettre 100 ml du culot dans 900 ml d'eau distillée stérile et ensemencer la totalité par inondation sur 4 tubes de milieu à l'oeuf (Löwenstein-Jensen ou Coletsos).
Ensemencer le reste du culot sur 6 tubes (4 à 5 gouttes par tube).
Bien répartir l'inoculum sur la surface du milieu de culture. Mettre à l'étuve à 37°C. Ne pas serrer les bouchons pour permettre l'évaporation de l'inoculum. Vérifier que les tubes restent bien à plat sur le portoir. Visser les tubes lorsqu'ils sont secs.
. Observation des cultures
La lecture des tubes est faite 1 fois par semaine. Les cultures sont incubées pendant 3 mois avant d'être considérées négatives.
2 - Technique radiométrique Bactec ® 460 TB (Becton Dickinson)
. EnsemencementLe sang est recueilli soit sur tubes type Vacutainer ®(5 ml sur SDS) ou inoculé directement dans le flacon Bactec 13A (5 ml) avec l'adaptateur Bactec (réf. 4405380 Becton Dickinson). Les flacons 13A ne doivent pas être gazés avant l'ensemencement. Avant de les placer à l'étuve, introduire de façon aseptique 0,5 ml de milieu d'enrichissement. Il est livré en même temps que les flacons 13A.
. Observation des cultures
La lecture des flacons se fait à raison de 2 fois par semaine pendant les 2 premières semaines, puis 1 fois par semaine pour un total de 8 semaines. L'incubation peut être prolongée jusqu'à 3 mois pour la détection de mycobactéries de croissance difficile (M. genavense).
Un index de croissance GI supérieur ou égal à 30 est considéré comme susceptible d'être positif. Quand l'index de croissance atteint 50, réaliser un frottis et le colorer par la méthode de Ziehl-Neelsen. Suivre ensuite la procédure réservée aux flacons 12B.
Si la coloration de Ziehl-Neelsen est négative, remettre le flacon en incubation pour contrôler sur des GI plus importants.
NB : Ne pas inoculer le culot de sang traité par la technique de centrifugation-lyse Isolator® dans les flacons de culture en milieu liquide car le tube Isolator® contient des inhibiteurs.
3 - Technique de fluorescence Bactec® 9240 (Becton Dickinson)
Principe
Le système Bactec® 9240 utilise une méthode de détection qui en permanence évalue dans le flacon de culture grâce à la présence d'un sel de ruthénium, la fluorescence consécutive à la réduction du milieu sous l'influence de la croissance microbienne.Le système de lecture complété d'un équipement informatique sophistiqué compare les mesures obtenues à un système algorithmique de référence et déclenche le signal de positivité quand la variation des différents paramétres est suffisante.
. Ensemencement des flacons Bactec® Myco F/lytic
5 ml de sang sont inoculés directement au lit du malade à l'aide d'un adaptateur (adaptateur Vacutainer réf : 364887 Becton Dickinson)
. Observation des cultures
Les flacons sont incubés dans l'appareil Bactec 9240 selon la notice du fabricant. La durée d'incubation est programmée pour 42 jours.
Un signal sonore et visuel indique les flacons positifs. Sur ces flacons, faire une coloration de Ziehl-Neelseen pour observer la présence de bacilles acido-alcoolo résistants et suivre la procédure habituelle d'identification (MO-MYC-005).
IV - ANNEXESA - Culture en milieu solide1 - Milieux prêts à l'emploiC - Culture en milieu diphasique
D - Hémocultures
A - Culture en milieu solide
1 - Milieux prêts à l'emploi
- Milieu de Löwenstein-Jensen
|
Firme |
Conditionnement |
Bouchon |
Code |
|
Sanofi Diagnostics Pasteur |
5 |
vis |
55245 |
|
50 |
vis |
55247 |
|
|
5 |
coton |
55246 |
|
|
50 |
coton |
55248 |
|
|
BioMérieux |
5 |
vis |
41694 |
|
100 |
vis |
41699 |
|
|
Oxoid |
10 |
vis |
02083 |
|
Becton-Dickinson |
10 |
vis |
4320908 |
|
100 |
vis |
4320909 |
- Milieu de Coletsos
|
Firme |
Conditionnement |
Bouchon |
Code |
|
Sanofi Diagnostics Pasteur |
5 |
vis |
53155 |
|
|
50 |
vis |
53157 |
|
|
5 |
coton |
53156 |
|
BioMérieux |
5 |
vis |
41904 |
|
|
100 |
vis |
41909 |
|
Oxoid |
10 |
vis |
36951 |
|
Becton-Dickinson* |
20 |
vis |
4356536 |
* La longueur des tubes est non standardisée (140 X 17 mm); les tubes ne s'adaptent pas à tous les portoirs.
2 - Milieux à reconstituer
a - Milieu de Löwenstein-Jensen
|
Firme |
Base pour milieu de |
Conditionnement |
Code |
|
Sanofi Diagnostics Pasteur |
Löwenstein-Jensen |
450 g |
69671 |
|
|
Coletsos |
450 g |
69661 |
|
Difco |
Löwenstein-Jensen |
500 g |
A5044417 |
|
|
Middlebrook 7H10 Middlebrook 7H11 |
500 g 500 g |
A5083801 A5083801 |
Préparation des milieux :
- Mettre 37,2 g de milieu sec dans 600 ml d'eau distillée froide contenant 12 ml de glycérol pour bactériologie. Mélanger jusqu'à obtention d''ne suspension homogène. Chauffer lentement en agitant constamment, puis porter 1 à 2 minutes à ébullition. Stériliser à l'autoclave à 121°C pendant 15 minutes.
- Préparer stérilement 1000 ml d'une suspension très homogène d'oeufs frais sans antibiotiques:
- Mettre à tremper les oeufs (environ 25 oeufs) dans une solution de soude à 5 % pendant 30 minutes.
- Rinçer à l'eau courante.
- Les mettre 10 minutes dans de l'eau additionnée d'un volume égal d'alcool dénaturé (1 litre d'eau + 1 litre d'alcool).
- Les laisser sécher sous la hotte.
- Chaque oeuf est cassé dans un premier temps dans un bécher stérile puis son contenu est versé dans une éprouvette stérile jaugée de 1 litre.
Tout oeuf suspect doit être jeté.
- Bien mélanger les oeufs, au mixer.
- Sous la hotte, filtrer le mélange, au chinois posé sur l'entonnoir.
- Mélanger aseptiquement 600 ml de base stérile et refroidie aux environs de 45-50°C et les 1000 ml d'oeufs entiers, toujours en évitant d'inclure des bulles d'air. Répartir stérilement le milieu complet en tubes stériles à raison de 6 ml par tube de préférence bouchés à vis.
- Coaguler en position inclinée, au coagulateur à trou, à l'étuve ou à l'autoclave à 85°C pendant 45 minutes.
b - Milieu de Coletsos
- Dissoudre 33,4 g de base déshydratée dans 600 ml d'eau distillée froide contenant 12 ml de glycérol pour bactériologie. Mélanger jusqu'à obtention d'une suspension homogène. Chauffer lentement en agitant constamment, puis porter à ébullition pendant 2 minutes. Stériliser à l'autoclave à 121°C pendant 15 minutes.
- Préparer stérilement 800 ml d'oeufs frais entiers et 200 ml de jaunes seuls (voir préparation des oeufs pour milieu de Löwenstein-Jensen).
- Mélanger aseptiquement et parfaitement les 600 ml de base stérile et refroidie aux environs de 45-60°C et l'ensemble des oeufs, en évitant d'inclure des bulles d'air. Répartir stérilement le milieu complet en tubes stériles de préférence bouchés à vis.
- Coaguler en position inclinée, au coagulateur à trou, à l'étuve ou à l'autoclave à 85°C pendant 45 minutes.
c - Milieux de Löwenstein-Jensen enrichis
1 - Avec du pyruvate de sodium
. à partir de milieu déshydraté- Préparation de 100 tubes de milieu de Löwenstein-Jensen-enrichi avec 0,2 % de pyruvate de sodium: mettre stérilement dans un Erlenmeyer 600 ml de milieu de Löwenstein-Jensen avant coagulation. Ajouter stérilement 6 ml de pyruvate de Na à 20 % (ampoules de 5 ml - Institut Pasteur réf. 62535 - à conserver à + 4°C). Bien agiter et répartir en tubes à raison de 6 ml par tube.
- Coaguler en position inclinée, au coagulateur à trou, à l'étuve ou à l'autoclave à 85°C pendant 45 minutes.
. à partir de milieu de Löwenstein-Jensen prêt à l'emploi- Les tubes de Löwenstein-Jensen sont imprégnés avec 0,2 ml d'une solution mère d'acide pyruvique (Merck réf. 6619) à 6 % de façon à obtenir une concentration finale de 0,2 %.
2 - Avec mycobactine J.
- Dissoudre la mycobactine (réf mycobactine J 2 mg; Rhône Mérieux, Lyon) en solution alcoolique à 0,05 % (2 mg de mycobactine dans 4 ml d'éthanol absolu). Ajouter la préparation à 1 litre de milieu de Löwenstein-Jensen avant coagulation. Ce milieu est utilisé pour la culture de souches de M. avium déficientes dans la synthèse de mycobactine.
3 - Avec du citrate de fer ammoniacal à 15 mg/ml.
- Faire une solution de citrate de fer ammoniacal à 1000 mg/ml dans l'eau distillée. Répartir 0,1 ml à la surface d'un tube de milieu de Löwenstein-Jensen. Ce milieu est utilisé pour la culture de M. haemophilum.
Dans tous les cas, les tubes doivent être stockés à + 4°C et à l'obscurité. Il est conseillé de soumettre un échantillonnage de chaque lot préparé à un contrôle de qualité et de stérilité.
4 - Milieu Middlebrook 7H11 - 7H10
Les milieux de base gélosés 7H11 ou 7H10 sont préparés selon les recommandations du fabricant, l'OADC (Difco A5 - 0722 -73), 20 ml pour 180 ml de base, sont ajoutés à 56°C avant gélification du milieu.
B - Culture en milieu liquide (hormis hémocultures)
1 - Technique radiométrique Bactec ® 460 TB (Becton Dickinson)
|
Désignation du produit |
Conditionnement |
Code |
|
Bactec 12B : milieu Middlebrook 7H12 pour isolement des mycobactéries dans des prélèvements autres que le sang (avec substrat C14)++ |
100 flacons |
4402004 |
|
Bactec PANTA PLUS (additif d'antibiotiques) |
250 tests |
4404764 |
++ livraison après avis favorable de la CIREA
NB : Pour les références concernant le matériel consommable et la maintenance du TB 460 consulter la notice du fabricant.
2 - Technique de fluorescence manuelle : BBL ® MGIT (Becton Dickinson)
Désignation du produit
Conditionnement
Code
Tubes MGIT BBL ® : Middlebrook 7H9 modifié
25 tubes
4345111
Tubes MGIT BBL ® : Middlebrook 7H9 modifié
100 tubes
4345113
MGIT OADC BBL ® : 15 ml de supplément d'enrichissement
6 ampoules
4345116
MGIT PANTA BBL ® pour 150 tests
6 ampoules
4345114
3 - Système MB/BactTTM (Organon Teknika)
|
Désignation du produit |
Conditionnement |
Code |
|
Flacons de culture MB/BacT |
100 flacons |
59591 |
|
Kit de décontamination MB/BacT - complément d'antibiotiques MB/BacT - solution de reconstitution MB/BactT |
100 tests 5 flacons/kit 5 flacons/kit |
59760 |
NB : Pour la maintenance du MB/BacT consulter la notice du fabricant.
C - Culture en milieu diphasique1 - Milieux de culture : BBL ® Septi - Check TMAFB (Becton Dickinson)
|
Désignation du produit |
Conditionnement |
Code |
|
AFB BBL ® Septi-Check bouillon : base liquide Middlebrook 7 H9 |
10 flacons |
4343558 |
|
AFB BBL ® Septi-Chek lame gélosée |
10 lames |
4343559 |
|
AFB BBL ® Septi-Check : supplément pour enrichissement et PANTA |
5 flacons |
4343560 |
D - Hémocultures
- Becton-Dickinson
|
Désignation du produit |
Conditionnement |
Code |
|
Bactec 13A avec supplément : milieu Middlebrook 7H13 pour isolement des mycobactéries dans le sang (avec substrat C14)++ |
|
4402018 |
|
Bactec 13A : milieu Middlebrook 7H13 (avec substrat C14)++ |
|
4402121 |
|
Myco/F lytic : milieu Middlebrook 7H9 modifié |
|
4402288 |
++ livraison après avis favorable de la CIREA
- Unipath-Oxoid
|
Désignation du produit |
Conditionnement |
Code |
|
Tubes Isolator ®10 BC 507C |
|
57781 |
|
Presse Isostat et portoir |
|
57811 |
|
Consommable BC 509 C (capuchon de prélèvement, pipette surnageant et pipette culot) |
|
57801 |
|
Adaptateur pour centrifugeuse BC 501C |
|
57821 |