Cette procédure a pour objet de définir les modalités pratiques de réalisation et interprétation d'un antibiogramme.
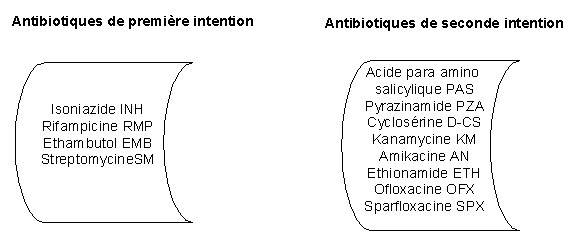
1 - Choix des antibiotiques
Le choix des antibiotiques dépend de la nature de la mycobactérie isolée.
Pour les mycobactéries du complexe tuberculosisUn antibiogramme est systématiquement réalisé avec un pool d'antibiotiques de première intention quand la souche est isolée pour la première fois.
Si la souche est isolée après trois mois de traitement, lors d'une rechute, ou secondairement sur toutes les souches présentant une résistance primaire, on aura recours aux antibiotiques de seconde intention.
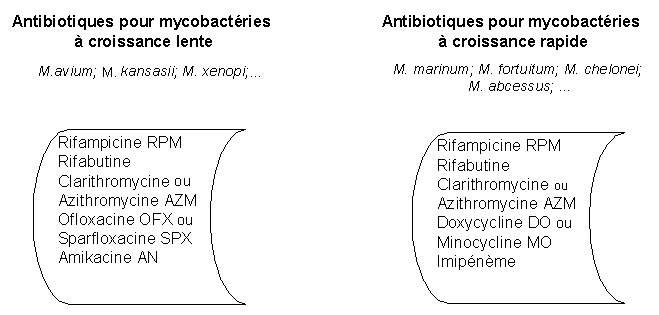
Pour les mycobactéries atypiques
Les mycobactéries non tuberculeuses sont peu sensibles aux antibiotiques.
Un pool d'antibiotiques est proposé selon la rapidité de croissance des mycobactéries (cf. annexe du document: Tableau III et IV).
Les résultats des tests réalisés in vitro ne permettent pas d'augurer avec certitude de l'efficacité de l'antibiotique lorsqu'il sera utilisé in vivo. En cas de rechute ils sont utiles pour détecter l'apparition d'une résistance secondaire.
En fonction de l'espèce isolée, la détermination de la sensibilité des mycobactéries aux antibiotiques peut se faire par :
A - La méthode des proportions décrite par Canetti, Rist et Grosset en 1963 pour Mycobacterium tuberculosis et les autres mycobactéries du complexe tuberculosis.
B - La méthode de détermination des CMI pour les mycobactéries opportunistes.
C - Les méthodes génétiques récemment développées pour la détermination rapide de la sensibibilité à la Rifampicine (cf. PR-MYC-002).
1 - Si la méthode est réalisée en milieu solide2 - Si la méthode est réalisée en milieu liquide
1 - Si la méthode est réalisée en milieu solide :
a - Principe
Cette méthode consiste à déterminer pour la souche à étudier la proportion de mutants résistants à un antibiotique donné. On l'obtient en dénombrant sur des milieux solides contenant la concentration critique d'antibiotiques (cf. annexes du document : tableau I et II) les colonies qui se sont développées. On compare ce nombre à celui des germes viables contenus dans le même inoculum et dénombrés sur milieux sans antibiotiques.
Le rapport des premiers aux seconds permet d'établir la proportion.
La comparaison de la proportion obtenue aux proportions critiques conventionnellement définies (cf.interprétation des résultats), permet d'établir si la souche à étudier est sensible ou résistante.
b - Matériel
- Tubes d'eau distillée stérile
- Pipettes graduées
- Anse de platine
- Erlenmeyer avec billes de verre de 6 mm de diamètre
- Vortex
- Témoin opacimétrique : suspension BCG à 1mg/ml (Sanofi Diagnostics Pasteur code 53211)
c - Réactifs
- Coffret antibiogramme des BK- bouchés coton (Sanofi Diagnostics Pasteur code 70302 n°ADM H 4861 1).
- Coffret antibiogramme des BK - bouchés vis (Sanofi Diagnostics Pasteur code 70301 n° ADM H 4862 1).
- Mycobiogramme : Coffret antibiogramme des BK (bioMérieux code 4 17301 N° ADM L06392).
- Série de tubes pour antibiogramme des BK (Sanofi Diagnostics Pasteur) :
. Capréomycine 20 µg/ml (réf 70212, n° ADM L 9802 1). Cyclosérine 30 µg/ml (réf 70262 n° ADM L 9809 1)
. Kanamycine 20 µg/ml (réf 70412 n° ADM L 9800 1)
. Pyrazinamide 200 µg/ml (réf 70472 n° ADM L 9801 1)
. PAS 0,5 µg/ml (réf 70462 n° ADM L 9822 1)
d - Technique
Deux méthodes sont utilisées
- la méthode indirecte à partir d'une souche déjà isolée.- la méthode directe, à partir du produit pathologique.
ß La méthode indirecte:
- Prélever avec une anse de platine environ 5 mg de colonies de BK (anse de platine pleine).
- Mettre ces bactéries dans un Erlenmeyer de 100 ml en verre stérile contenant des billes de verre de 6 mm de diamètre.
- Agiter l'Erlenmeyer à sec pendant 10 minutes.
- Ajouter 0,1 ml d'eau distillée stérile et agiter 10 à 15 secondes.
- Ajouter ensuite 5 ml d'eau distillée stérile et agiter 10 à 15 secondes.
- Ajuster l'opacité de la suspension par rapport à l'opacité d'une suspension bacillaire de BCG à 1 mg/ml par ajout d'eau distillée
- Préparer à partir de cette suspension, 3 dilutions 10-1, 10-3, 10-5 qui seront réparties à raison de 0,2 ml par tube de milieu.
- Incuber à 37°C les tubes ouverts en position horizontale.
- Fermer les tubes une fois que le liquide est évaporé, environ après 3 à 4 jours d'incubation.
ß La méthode directe:
- Faire une suspension mère en ajoutant 3 ml d'eau distillée stérile au culot de centrifugation, homogénéisé et riche en BAAR (>1 BAAR/champ à la coloration de Ziehl et à l'objectif 100).
- Réaliser à partir de la suspension mère des dilutions jusqu'à 10-2.
- Ensemencer les 3 dilutions à raison de 0,2 ml par tube.
- Incuber à 37°C les tubes ouverts en position horizontale.
- Fermer les tubes une fois que le liquide est évaporé, environ après 3 à 4 jours d'incubation.
Remarques :
. En cas de tubes bouchés au coton, flamber le coton avant de l'introduire dans le tube.
. Changer de pipette à chaque dilution.
e - Lecture et interprétation
La lecture peut se faire à partir du 21ème jour.
- Compter le nombre de colonies apparues sur les tubes témoins et sur les tubes contenant les antibiotiques. En déduire la proportion obtenue.
(La lecture doit se faire avec la dilution pour laquelle il est possible de compter les colonies sur le tube témoin environ 100 colonies).
- Comparer cette proportion avec les proportions critiques adoptées.
La proportion critique est de 1 % pour l'INH, la RMP, l'EMB, la SM.
Une souche est résistante si la proportion obtenue est supérieure à 1 %.
Une souche est sensible si la proportion obtenue est inférieure à 1 %.
La proportion critique est de 10 % pour tous les antibiotiques de seconde intention: PAS, PZA, ETH, D-CS..., (à l'exception des fluoroquinolones et de l'amikacine qui seront testés par la méthode des CMI).
Remarques :
En ce qui concerne l'INH, 3 ou 4 concentrations sont étudiées, car il existe plusieurs niveaux de résistance.
Pour les résistances à très bas niveau, on considérera comme sensibles, les souches résistantes à 0,1 mg/l et sensibles à 0,2 mg/l.
Cette résistance est souvent primaire. Elle intéresse 3 à 4 % des souches.
La résistance peut être primaire ou acquise pour les souches résistantes à 0,2 mg/l et à 1 mg/l.
La détermination de la proportion critique de bacilles résistants au PZA doit comparer le milieu avec antibiotique à un témoin du même milieu acidifié (pH 6,6) étant donné que le PZA n'a d'activité qu'en pH acide. La culture des mycobactéries du complexe tuberculosis est parfois fortement diminuée à ce pH ce qui rend souvent le test ininterprétable par culture négative sur le témoin.
A l'inverse, le milieu peut n'être qu'insuffisamment acidifié rendant inactif le PZA et permettant la culture sur milieu avec antibiotique malgré la sensibilité de la souche. Il est habituel de considérer que si le pH acide est respecté, la culture sur le milieu témoin est environ de 10 % par rapport au témoin milieu pH neutre, le test est alors interprétable.
2 - Si la méthode est réalisée en milieu liquide :
Deux types de méthodes :
- Une méthode visuelle, peu utilisée : Antibio test Mycobacterium (Sanofi Diagnostic Pasteur).
- Une méthode radiométrique : Technique Bactec 460 TB (Becton Dickinson).
La méthode radiométrique
a - Principe
La technique Bactec de mesure de la sensibilité aux antibiotiques repose sur le même principe que la méthode des proportions réalisée en milieu solide. Mais plutôt que de dénombrer des colonies, en milieu liquide et en atmosphère confinée on utilisera comme indicateur de croissance la production de 14CO2 en présence ou en absence dëantibiotiques.
La sensibilité se manifeste par une inhibition de croissance dans les flacons contenant les antibiotiques. Celle ci est comparée à la croissance observée dans les milieux témoins sans antibiotique inoculés dans les mêmes conditions que le test (témoins 100 %) et les témoins inoculés avec la dilution au 1/100 de la précédente (témoins 1 %).
Une souche est considérée comme sensible quand la croissance obtenue en présence d'antibiotiques est inférieure à celle du témoin 1 %.
b - Matériel
- Seringues à usage unique de 1 ml
- Öses stériles à usage unique
- Tubes stériles à bouchon à vis et à fond rond (16x125 mm)
- Billes de verre stériles de 6 mm de diamètre (facultatif)
- Tubes Eppendorf de 1,5 ml pour congélation
- Pipette automatique de 200 µl et embouts
- Eau distillée stérile
- Echelle Mac Farland Standard 0,5 - 2 (bioMérieux réf 14950)
c - Réactifs
- Flacons 12B (Becton-Dickinson réf 4402004, n°ADM F0381 1).
- BACTEC S.I.R.E. : Streptomycine, Isoniazide, Rifampicine et Ethambutol (Becton-Dickinson ref 4402102, n°ADM F0 384 1).
- BACTEC DF : liquide de dilution (Becton-Dickinson réf, 002104 n°ADM )
- Flacons PZA test medium (Becton-Dickinson réf 4402139, n°ADM J6535 0)
- Solution pyrazinamide (Becton-Dickinson réf, 4402143 n°ADM J6536 0)
d - Technique
Vérifier les flacons 12B :
- Avant tout ensemencement tester les flacons 12B pour y établir une atmosphère à 5 % de CO2.
- Vérifier le GI et jeter tout flacon dont le GI est supérieur à 10.
Préparer les antibiotiques :
- Préparer les solutions mères d'antibiotiques selon les concentrations indiquées dans le tableau II.
Remarques :
. Changer de seringue pour chaque antibiotique.
. Les solution mères d'antibiotiques sont congelées à -20°C, sous forme d'aliquots de 300 µl.
Préparer l'inoculum :
L'inoculum peut être réalisé aussi bien à partir d'une culture en milieu liquide en flacon 12B ou d'une culture pure en milieu solide.
A partir d'une culture en flacon 12B :
L'antibiogramme ne peut être réalisé que si le GI est compris entre 500 et 999. Si la valeur du GI est de 999, faire une prédilution au 1/2, réincuber le flacon à 37°C jusqu'à obtention d'un GI supérieur ou égal à 500.
- Homogénéiser l'inoculum en aspirant et refoulant plusieurs fois le milieu à l'aide d'une seringue de 1 ml à usage unique.
- Prélever directement 0,1 ml de la suspension pour ensemencer les flacons 12B contenant les différents antibiotiques.
A partir d'une culture en milieu solide :
- Prélever une anse de culture et transférer dans un tube stérile à bouchon à vis et à fond rond contenant 3 ml de liquide de dilution et 3 à 10 billes de verre stériles.
- Homogénéiser au Vortex® pour bien disperser la culture et obtenir une suspension légèrement trouble.
- Laisser reposer 30 minutes.
- Reprendre le surnageant dans un tube à essai stérile et ajuster la turbidité à 1 sur l'échelle MacFarland, ou à 0,5 si aucune lecture de croissance n'est réalisée durant le week-end.
Inoculer les flacons pour l'antibiogramme :
- Bien identifier chaque flacon et le flacon témoin sans antibiotique.
- Prélever à l'aide de seringues à usage unique 0,1 ml de la solution d'antibiotique
- Injecter dans les flacons 12B contenant les antibiotiques correspondants.
- Injecter 0,1 ml d'une dilution au 1/100 (transférer 0,1 ml de la suspension bactérienne testée dans 9,9 ml de liquide spécial de dilution, bien agiter avant de prélever) dans le flacon témoin.
Remarques :
Après chaque ensemencement, désinfecter le bouchon de chaque flacon à l'alcool à 70°.
e - Lecture et interprétation
La lecture est effectuée chaque jour, jusqu'à ce que le GI du flacon témoin à 1% soit supérieur ou égal à 30.
La durée du test s'échelonne entre un minimum de 4 jours et un maximum de 12 jours.
Les flacons pour antibiogramme ayant été ensemencés avec un inoculum 100 fois plus fort que celui du flacon témoin à 1%, ils présenteront lors des premières lectures, des GI supérieurs à celui obtenu pour le flacon témoin à 1%. Mais celui-ci augmentera ensuite de façon progressive et l'interprétation de l'antibiogramme pourra être effectuée.
On déterminera alors le DGI :
DGI = La différence entre les valeurs de GI obtenues un jour donné et le jour suivant.
Si DGI témoin > DGI antibiotique souche sensibleSi DGI témoin < DGI antibiotique souche résistante
Si DGI témoin = DGI antibiotique résultat ininterprétable
Principe
Il s'agit de mettre un inoculum bactérien en contact avec des concentrations décroissantes d'antibiotiques afin de déterminer, après un temps de contact à 37°C, la plus faible concentration d'antibiotique capable d'inhiber 99 % de l'inoculum.
La détermination des CMI peut être réalisée par:
1 - La méthode des dilutions en milieu gélosé
2 - La méthode des dilutions en milieu liquide
3 - La technique des bandelettes E-test
1 - Méthode des dilutions en milieu gélosé
a - Principe : voir ci-dessus
b - Matériel
- Boîtes de Pétri
- Tubes d'eau distillée stérile
- Pipettes graduées
- Pipette automatique et embouts
- Vortex
- Bain marie
- Echelle Mc Farland Standard 0,5 - 2 (bioMérieux réf 14950)
- Témoin opacimétrique suspension BCG à 1mg/ml (Sanofi Diagnostics Pasteur code 53211)
c - Réactifs
- Antibiotiques (cf. tableau II en annexe du document)
- Les solvants pour la réalisation des solutions mères d'antibiotiques
(cf. tableau I en annexe du document).
d - Technique
Préparer les milieux avec antibiotiques
- Préparer les solutions mères d'antibiotiques selon le tableau II.
- Incorporer les solutions d'antibiotiques dans le milieu de base avant gélification, en même temps que l'OADC pour les milieux Mueller-Hinton et 7H10, et avant coagulation pour le milieu Lowenstein.
Remarque :
La solution antibiotique est diluée au 1/10 dans la gélose (2ml de solution d'antibiotiques dans18 ml de gélose pour des boîtes de Pétri de 90 à 100 mm de diamètre).
Préparer l'inoculum
L'inoculum peut être préparé soit à partir de la primo-culture, soit à partir d'une culture en milieu liquide 7H9.
A partir d'une culture en milieu solide
- Disperser les colonies dans l'eau stérile
- Mélanger au vortex de façon à obtenir une suspension homogène
- Ajuster à 1 mg/l à l'aide de l'échelle opacimétrique BCG ou de la suspension Mc Farland standard 1.
A partir d'une culture en milieu liquide 7H9
- Centrifuger une culture du milieu 7H9 (enrichi de OADC) ou de milieu Dubos Tween 80.
- Reprendre le culot et ajuster l'opacimétrie à 1mg/ml.
Mettre en culture
- Diluer la suspension bactérienne à 1 mg/l en progression géométrique de raison 10 jusqu'à 10-5.
- Ensemencer en quadrant 50 m l de la dilution 10-3. On ensemencera 2 quadrants témoins sans antibiotique et un quadrant par dilution de l'antibiotique à tester.
- Ensemencer la suspension diluée à 10-5 de la même façon.
- Incuber à 37°C, en sac plastique. Le temps d'incubation dépend de la mycobactérie testée.
Sur milieu Löwenstein, les tubes seront inoculés avec les mêmes dilutions mais avec un volume de 0,1 ml. Ils seront ensuite incubés à 37°C en position horizontale.
e - Lecture et interprétation
Dénombrer les colonies sur chacun des quadrants ou tubes. La CMI est la plus faible concentration d'antibiotique pour laquelle l'inhibition de croissance est supérieure à 99%.
2 - Méthode des dilutions en milieu liquide
Deux types de méthodes sont utilisées :
- La méthode visuelle Antibio test Mycobacterium.
- La méthode radiométrique Bactec 460TB
2.1 - Antibio-test Mycobacteriuma - Principe
L'Antibio-test se réalise en milieu liquide de Youmans. Le test doit être considéré comme une adaptation au milieu liquide de la méthode des proportions : pour la majorité des antibiotiques testés, le seuil de résistance clinique est fixé à une proportion critique de 2 %. La lecture se fait par appréciation visuelle de la croissance.
b - Matériel
- Seringues stériles de 1 et 5 ml à usage unique
- Pipettes et poires ou système de prélèvement
- Spatules ou öses
- Dispositif pour aération des flacons Diagsafe® (Sanofi Diagnostics Pasteur code 55160)
- Bouclier protecteur (Sanofi Diagnostics Pasteur code 70196)
- Témoin opacimètrique suspension BCG à 1 mg/ml (Sanofi Diagnostics Pasteur code 53211)
c - Réactifs
Antibio-test Mycobacterium (Sanofi Diagnostics Pasteur code 70195)
Ce coffret comprend deux séries de flacons :
- flacons témoins (milieux de Youmans)- flacons tests INH 0,2 et 0,5 µg/ml, SM 5 µg/ml, RMP 2 µg/ml, EMB 12µg/ml
- flacons pré-culture R1 (Sanofi Diagnostics Pasteur code 70188): eau glycérinée.
- flacons pré-culture R2 (Sanofi Diagnostics Pasteur code 70189) : Youmans.
d - Technique
Préparer l'inoculum
A partir d'une culture sur milieu solide :
- Préculture en milieu de Youmans : L'objectif de la pré-culture est de permettre l'adaptation au milieu liquide de la souche et l'obtention d'une culture en phase exponentielle de croissance.
- Prélever à l'anse de platine l'équivalent d'une colonie de taille moyenne et l'introduire dans un flacon de préculture R1. Bien homogénéiser la suspension bactérienne.
- Désinfecter le bouchon d'un flacon avec un écouvillon ou un coton imbibé d'alcool éthylique à 70°.
- A l'aide d'une seringue aspirer la totalité de la suspension contenue dans le flacon R1 et l'introduire dans le flacon R2. Homogénéiser le contenu du flacon R2 et procéder à son aération à l'aide d'un dispositif. Incuber ce flacon 4 jours à 37°C.
A partir d'une culture en milieu liquide sans pré-culture :
Lorsque l'intensité de la croissance dans le bouillon est suffisamment importante (présence d'au moins 10 dans la totalité du bouillon), l'étape de pré-culture n'est pas nécessaire. Ce bouillon bien homogénéisé sera considéré comme l'équivalent au flacon R2.
A partir d'une culture en milieu liquide avec pré-culture :
Lorsque l'intensité de croissance obtenue dans le milieu est insuffisante (moins de 10 dans la totalité du bouillon), une pré-culture en milieu de Youmans devra être réalisée: après homogénéisation de la culture positive, aspirer à la seringue entre 1 et 3 ml de bouillon selon la richesse en grains du flacon (2ml si 5 à 9 grains; 3 ml si 1 à 5 grains) et les introduire dans un flacon de pré-culture R2. Compléter par de l'eau glycérinée (EGT) q.s.p. 5 ml prélevée dans un flacon de pré-culture R1, incuber le flacon R2 pendant 4 jours à 37°C.
Préparer la gamme témoin de croissance
L'inoculation des flacons est effectuée à l'aide de seringues stériles. Toujours placer les flacons dans le support approprié (bouclier protecteur) lors des injections à la seringue. Désinfecter les bouchons de l'ensemble des flacons (suspension 100 %, 40 %, 2 %, 0,1 %, flacons tests, flacons témoins) comme précédemment décrit.
Suspension 100 % : après 4 jours d'incubation du flacon R2, homogénéiser le contenu de ce flacon par retournement, prélever 2 ml de culture à la seringue et les introduire dans un flacon. Pour la suspension 40 % introduire de la même façon 1 ml de la suspension 100 % dans le flacon.
Pour la suspension 2 %, introduire 1 ml de suspension 40 %, pour la suspension 0,1 %, 1 ml de suspension à 2 %.
Les suspensions 0,1 %, 2 %, 40 % et 100 % sont utilisées pour ensemencer des flacons étiquetés afin d'obtenir la gamme de témoin croissance.
Préparer l'antibiogramme
Introduire successivement 1 ml de la suspension 100 % bien homogénéisée dans la série de flacons contenant les antibiotiques à tester. Procéder à l'aération de l'ensemble des flacons à l'aide d'un dispositif Diagsafe® puis les incuber à l'étuve à 37°C pendant 5 à 8 jours.
e - Lecture et interprétation
L'interprétation de l'antibiogramme doit être réalisée dès qu'une croissance est décelée dans le flacon témoin 2 %. En pratique, on effectuera une première lecture dès le 4ème jour d'incubation, puis quotidiennement jusqu'à ce que la croissance dans le témoin 2 % soit observable. La lecture des autres flacons sera alors réalisée et ne devra plus être différée.
Pour M. tuberculosis, le délai moyen pour l'interprétation des résultats se situe entre 4 et 8 jours d'incubation. M. tuberculosis et BCG donnent en 5 à 8 jours un dépôt avec surnageant clair et après remise en suspension un aspect granulaire, M. bovis donne une culture homogène. Un gradient de croissance doit être visible entre les témoins 0,1, 2 et 40 %. Un trouble homogène décelable sur l'ensemble des flacons et en particulier dans les flacons contenant de l'INH de l'EMB et du PAS doit faire penser à une contamination, un contrôle doit alors être réalisé en effectuant une coloration de Ziehl et une coloration de Gram.
Pour l'ensemble des antibiotiques testés l'intensité de croissance (IC) obtenue dans chaque flacon test doit être comparée à celle obtenue dans le flacon témoin 2 % et l'interprétation de l'antibiogramme se résume ainsi :
Si IC- Test < IC- Témoin 2 % la souche est dite sensibleSi IC- Test > IC- Témoin 2 % la souche est dite résistante
a,b,c - Pour le principe, le matériel et les réactifs, se reporter au chapitre A 2.
d - Technique
Vérifier les flacons 12B :- La première opération consiste à établir au sein des flacons une atmosphère gazeuse enrichie de 5 % de CO2.
- Vérifier le GI et rejeter tout flacon dont le GI est supérieur à 10.
Préparer les antibiotiques- Préparer les solutions mères d'antibiotiques selon les concentrations indiquées dans le tableau II.
Pour la clarithromycine, le pH 7,2 du milieu, indispensable au test, est réalisé par addition d'une solution d'hydrogénophosphate disodique Na2HPO4.
Remarques :
Changer de seringue pour chaque antibiotique.
Les solutions mères d'antibiotiques sont congelées à -20°C, sous forme d'aliquots de 300 µl.
Préparer l'inoculumL'inoculum peut être réalisé aussi bien à partir d'une culture pure en milieu solide ou à partir du milieu Bactec.
Prélever des colonies sur milieux solides et faire une suspension en tampon pH 7,2 ou avec le Bactec diluting fluid.
- Ajuster la turbidité à 1 Mac Farland.
- Injecter 0,1 ml de cette suspension dans un flacon 7H12 (12B) pendant 48 à 72 heures jusqu'à obtention d'un GI de 500 à 999. Cette culture constitue la suspension mère.
Inoculer les flacons pour l'antibiogrammeBien identifier chaque flacon et le flacon témoin sans antibiotique.
- Diluer la suspension bactérienne mère en progression géométrique de raison 10 jusqu'à 10-4.
- Inoculer 0,1 ml de la suspension 10-2 dans 1 flacon témoin sans antibiotique (témoin 100 %).
- Inoculer 0,1 ml de la suspension 10-2 dans les flacons contenant les différentes dilutions d'antibiotiques.
- Inoculer 0,1 ml de la suspension 10-4 dans un flacon 7H12 sans antibiotiques pour d'obtenir le témoin 1%.
- Incuber les flacons à 37°C.
e - Lecture et interprétation
La lecture est effectuée chaque jour, jusqu'à ce que le GI du flacon témoin 1% soit supérieur ou égal à 20 et s'y maintienne au moins trois jours consécutifs, et que le G.I. du flacon 100 % ait atteint.
Ces lectures sont réalisées au minimum pendant 4 jours et au maximum pendant 8 jours. Le jour de l'inoculation étant considéré comme le jour 1.
Le G.I. du flacon contenant l'antibiotique à la concentration égale à la CMI au moment de l'interprétation doit être inférieur à celui du flacon témoin à 1 %.
La CMI est la plus faible concentration d'antibiotique pour laquelle l'inhibition de croissance est supérieure à 99%.
a - Principe
Il s'agit d'une fine bandelette de plastique inerte et non poreux imprégnée sur sa face inférieure par un gradient exponentiel et prédéfini d'antibiotique séché et immobilisé. Dès que la bandelette est appliquée à la surface de la gélose, il se produit un transfert immédiat de l'antibiotique sur la gélose, le gradient continu et exponentiel d'antibiotique est alors crée directement le long de la bandelette. Après incubation on observe une zone d'inhibition en forme d'ellipse répartie symétriquement de chaque côté de la bandelette, le point d'intersection entre la bandelette et l'extrémité inférieure de la zone d'inhibition indique la CMI de la souche. On peut l'exprimer directement en microgrammes par millilitre en se référant à l'échelle graduée inscrite sur la bandelette.
b - Matériel
- Boîtes de Pétri
- Etalon standard de McFarland 0,5
- Ecouvillons stériles
- Pipettes pasteur
- Billes de verre
- Tubes de conservation (réf ETZZ 6000)
c - Réactifs
- Bandelettes E - test (liste des antibiotiques brochure)
- Applicateur de bandelettes (réf ETZZ 5999)
- Bouillon Middlebrook 7H9 (Difco/OSI n° A5071317)
- Milieu Middlebrook 7H11 (Difco/OSI n° A5062717)
- OADC w/WR 1339 (Difco/OSI n° A5080163)
- Milieu Mueller-Hinton
- Souche de référence M. fortuitum ATCC 6841
d - Technique
Préparer l'inoculum
- Pour M. avium complexe et M. kansasii, l'inoculum doit être une suspension bactérienne Mc Farland 4 réalisée en bouillon 7H9 ou un milieu 7H12 (Bactec) inoculé dont le GI a atteint 999.
- Pour les mycobactéries à croissance rapide (M. chelonei, M. fortuitum...) l'inoculum doit être une suspension bactérienne Mc Farland 1 réalisée en tampon PBS ou un milieu 7H12 (Bactec) inoculé dont le GI est = 200-300.
Ensemencer
Il est recommandé d'effectuer l'ensemencement par écouvillonnage.
- Plonger un écouvillon stérile dans la suspension
- Sortir l'écouvillon du tube en l'essorant doucement sur la paroi
- Ensemencer la boîte en frottant l'écouvillon sur sa surface et en tournant la boîte afin d'assurer une bonne distribution de l'inoculum.
Incuber
Les milieux utilisés pour M. avium complexe, et M. kansasii sont le milieu 7H11+ OADC ou le milieu Mueller- Hinton enrichi avec 5 % de sang de cheval défibriné.
Une préincubation de 24 heures est fortement conseillée avant l'incubation qui sera de 5 à 7 jours à 35-37°C + 5 % CO2.
Les milieux utilisés pour les mycobactéries à croissance rapide sont le milieu de Mueller-Hinton simple ou enrichi avec 5 % de sang de cheval défibriné.
L'incubation sera de 72 heures à 37°C + 5 % CO2.
Remarques :
Bien sécher les boîtes avant l'application des bandelettes
Conserver les bandelettes E-test non utilisées dans un tube de conservation avec un dessicant à -20°C.
e - Lecture et interprétation
Lire directement la valeur de la CMI correspondant à l'intersection des 2 ellipses d'inhibition. Si l'on observe des micro ou des macro colonies, une double zone ou bien une zone d'inhibition mal délimitée, lire la valeur de CMI où la croissance bactérienne est complétement inhibée.
4 - Antibiogramme par diffusion
Cette méthode est utilisée pour les mycobactéries à croissance rapide, M. marinum et les mycobactéries du groupe IV de Runyon.
a - Principe
Il consiste à déposer à la surface de la gélose ensemencée d'une boîte de Pétri des disques de papier buvard imprégnés des différents antibiotiques testés. Chaque antibiotique diffuse dans la gélose à partir du disque et y détermine des gradients de concentrations. La zone d'inhibition observée après incubation est proportionnelle à la CMI de la souche vis-à-vis de l'antibiotique testé.
b - Matériel
- Boîtes de Pétri
- Tubes d'eau distillée stérile
- Pipettes graduées
- Pipettes Pasteur
- Témoin opacimètrique suspension BCG à 1 mg/ml (Sanofi Diagnostics Pasteur code 53211)
c - Technique
- Préparer une suspension à 1 mg/ml de la souche à étudier à partir d'une culture en phase exponentielle de croissance (sur milieu de Löwenstein-Jensen incubé depuis 3 à 4 jours ou en milieu de Dubos de 48 heures).
- Faire une dilution en eau distillée stérile à 10-2 et 10-4 .
- Inonder la surface de deux boîtes de Mueller-Hinton enrichi de sang, l'une avec la suspension 10-2, l'autre avec la suspension 10-4.
- Aspirer l'excès d'eau. Faire sécher à l'étuve.
- Déposer les disques d'antibiotiques.
- Placer à 30°C (la température de 30°C est impérative pour M. marinum et elle est souvent préférable pour les mycobactéries à croissance rapide).
- Faire la lecture à 3 et à 7 jours.
d - Interprétation
On peut considérer que la souche est résistante , si le diamètre d'inhibition est inférieur à 10 mm; s'il est supérieur à 10 mm, il peut y avoir une activité potentielle de l'antibiotique, il est alors souhaitable de déterminer la CMI de l'antibiotique selon les techniques précédemment décrites.
En ce qui concerne l'interprétation de la sensibilité in vitro des mycobactéries atypiques, si la détermination de la CMI ne pose pas de problème, l'interprétation en Sensible, Intermédiaire ou Résistant est plus délicate, elle dépend de la technique et du milieu utilisé.
Des concentrations critiques ont été définies pour certains antibiotiques.
Exemple :
Pour la Clarithromycine, la concentration critique est de 4 mg/l.
En routine, on réalisera 2 concentrations de 4 et 32 mg/L.
Pour la Rifabutine les concentrations critiques dépendent du milieu utilisé
< 0,5 - > 2 mg/l en 7H12< 1 - >4 mg/l en 7H10 et 7H11
<10 - >40 mg/l en Löwenstein
Pour les autres antibiotiques il n'existe aucune standardisation, les concentrations critiques définies pour les autres bactéries peuvent éventuellement servir de référence.
TABLEAU I : Concentrations critiques selon les milieux (µg/ml)
INH
PAS
8
SM
2
4
5
2
2
2
2
5