1. INTRODUCTION


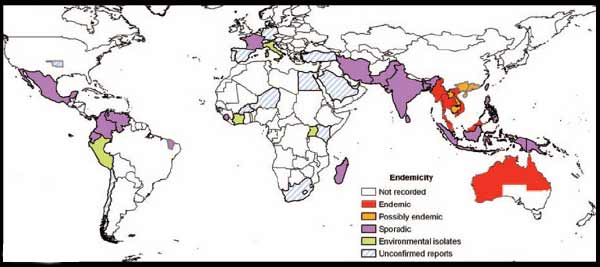
La mélioïdose est une affection peu rencontrée en France, car il s’agit d’une maladie rare et exotique, due à une bactérie tellurique et hydrique: Burkholderia pseudomallei. Cette maladie est due à un bacille à Gram négatif aérobie strict qui se rencontre essentiellement entre les 20ème parallèles nord et sud avec une nette prédominance dans le sud-est asiatique et le nord de l'Australie. Son taux de mortalité est d’environ 30-40% en l'absence de traitement.

- D’autres zones d’endémie existent en Afrique ou encore en Amérique du Sud. La maladie peut être autochtone en France, suite à l’épizootie de la ménagerie du Jardin des Plantes de Paris, en 1975. Il peut s'agir d'une zoonose, le germe étant tellurique.
Cette maladie est opportuniste, rapportée préférentiellement chez des patients immunodéprimés dont le traitement est long et difficile avec un mauvais pronostic (taux de létalité et celui de rechute élevés).

- L' origine exotique n'exclut nullement son implication en Europe comme en France où plusieurs cas annuels sont rapportés. D'ailleurs, suite au tsunami de décembre 2005, une alerte a été lancée en France.
- La découverte en France est le plus souvent fortuite chez des malades hospitalisés. D'ailleurs, la galerie d'identification biochimique telles API 20E API 20NE...... peut rapidement vous orienter et le diagnostic de cette bactérie devra être confirmé le plus rapidement possible.
- Enfin, il s'agira d' un agent potentiel du bioterrorisme (agent biologique de la classe 3) (http://www.cnrs.fr/SDV/Dept/ogmclassi2.html).
Guide d'investigation: http://www.agmed.sante.gouv.fr/htm/10/biotox/morve.pdf
2. HISTORIQUE
http://www.bacterio.cict.fr/bacdico/bb/pseudomallei.html
|
. La mélioïdose et la bactérie (Pseudomonas pseudomallei) furent observées pour la première fois par le capitaine A. Whitmore, pathologiste anglais, et son assistant, CS. Krishnaswamiv à l’hôpital général de Rangoon (à droite) en Birmanie chez un opiomane (1911). Cette maladie fut, ensuite, rapportée chez 38 cas d'infections de type septicémie, associée à de nombreux abcès caséeux (poumons, foie, rate). |
 |
 |
. En 1921, Stanton et Fletcher rapportent aussi les infections chez l’animal en donnant le nom de pseudomorve qui montre de nombreuses similitudes cliniques et anatomo-pathologiques avec la morve dont l’agent est Burkholderia mallei. La morve est une infection pulmonaire des équidés transmise accidentellement à l'homme. Cette maladie a été éradiquée en France par la vaccination systématique des chevaux au début du siècle dernier. |
. La mélioïdose fut décrite dans plusieurs pays du sud-est asiatique: Sri Lanka ( 1927), Singapour et Indochine en 1932. Jusqu'en 1949, on a longtemps pensé que la mélioïdose était surtout localisée en Asie. Dans les années 1950, une centaine de cas fut identifiée parmi les 400.000 soldats français en Indochine, puis dans les années 70, parmi les soldats américains (343 cas avec 36 décès) lors de la guerre du Vietnam. Sur les 2,5 millions de soldats américains, le nombre de cas de mélioïdose sub-clinique est estimé à 225.000. Enfin la maladie peut être rapportée dans certains pays chauds comme les États-Unis, Panama et la Turquie chez des malades n'ayant été en zone d’endémie. L’Afrique n’est pas épargnée avec l’isolement de la bactérie chez l’animal (porc) dès 1936 et le premier cas humain au Tchad (1960). Le bacille de Whitmore fut retrouvé en Iran chez le cheval (1943) puis dans les eaux et les rizières. Cette bactérie est très connue dans certaines régions du globe. De nombreuses espèces de mammifères y sont sensibles, ainsi en 1975, 24 dauphins de l’aquarium océanique de HongKong décèdent de mélioïdose.
. En France, le bacille fut isolé, pour la première fois, chez une jument de Prejwalski morte en 1975 au Jardin des Plantes. D’autres espèces animales en moururent (mouflon du Canada, singe Patas, cerfs Sika, un tatou….). Divers isolements du germe ont été positifs à partir d'échantillons du sol de plusieurs régions françaises. Des cas équins ont été rapportés dès 1976: Yvelines, Seine-et-Marne puis Normandie, Camargue, Aquitaine.......
L’hypothèse de l’origine de cette contamination semblait fortement liée à l’importation d’un panda, cadeau de Mao Tse Tung au président Pompidou (1973) en provenance d’un site géographique infecté. Celui-ci placé au parc zoologique de Vincennes y décéda quatre mois plus tard. L’autre hypothèse était la contamination par l’intermédiaire de 2 chevaux d’Iran offerts à Madame Pompidou par le Shah en 1971, en contact avec les chevaux de Prejwalski. Cependant, il n’y a pas eu de mélioïdose déclarée chez ces animaux.
Enfin, 3 cas humains de mélioïdose dont 2 décès furent rapportés, suite à cette épizootie équine et B. pseudomallei a été ioslé par hémoculture chez 2 personnes asymptomatiques.
Quelques cas annuels de mélioïdose humaine sont régulièrement rapportés, le plus souvent chez des immigrés asiatiques implantés en France ou des patients immunodéprimés revenant de zones d’endémie. Le tsunami de décembre 2005 a amené les autorités françaises à lancer une alerte : http://www.invs.sante.fr/presse/2005/le_point_sur/tsunami_020205/
3. TAXONOMIE - CLASSIFICATION
Ces bactéries appartiennent au beta-proteobacteria, à l'ordre des Burkholderiales et à la famille des Burkholderiaceae avec les genres Burkholderia, Pandoraea, Ralstonia...... Le germe de la mélioïdose a été primitivement dénommé par A. Whitmore, Bacillus pseudomallei. En 1957, Haynes le transfère dans le genre Pseudomonas et classé dans le groupe génomique II. Cette bactérie a été récemment individualisée (Yabuuchi et coll., 1992) en un nouveau genre Burkholderia sur des critères génomiques ou non : séquence ARNr 16S, homologies ADN-ADN, composition des acides gras et caractéristiques phénotypiques.

http://www.ncbi.nlm.nih.gov/Taxonomy/Browser/wwwtax.cgi?id=32008
http://www.bacterio.cict.fr/b/burkholderia.html
Ce genre compte au moins 6 espèces d'intérêt médical dont Burkholderia pseudomallei, très proche de B. mallei, responsable de la morve, très ressemblante à la mélioïdose. Ces 2 bactéries ne forment qu’une espèce unique (plus de 90 p. cent d'homologie ADN - ADN). Seules, la pathogénie et l’épidémiologie conduisent à maintenir l’existence d'espèces différentes comme Escherichia coli et Shigella spp..
| B. pseudomallei |
| B. mallei |
| B. thailandensis |
| B. multivorans |
| B. cepacia (espèce-type) |
| B. urbonensis |
- Les génomes de B. pseudomallei (souches K96243, S13, Pasteur......) et B. mallei (ATCC 23344) sont connus depuis peu (2004-2005). Le génome de B. pseudomallei est composé de 2 chromosomes (4,07 et 3,17 Mbp) pour un GC% de 67-68% :
http://www.ncbi.nlm.nih.gov/genomes/lproks.cgi?view=1
4. PRINCIPAUX CARACTERES BACTERIOLOGIQUES
. B. pseudomallei est un bacille à Gram négatif (coloration bipolaire +), de 0,5 à 2 mm de longueur, non sporulé, exprimant des exopolysaccharides de surface (microcapsule)(synthèse constitutive), mobile grâce à une ciliature polaire et multitriche.
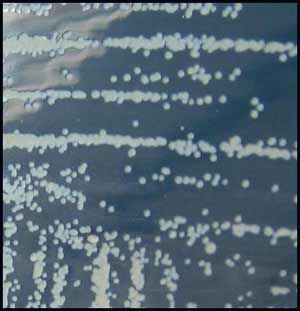
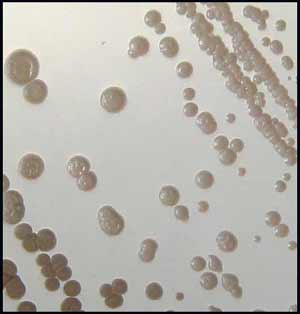
. La température optimale de croissance est comprise entre 37-39 °C, mais nombre de souches cultivent bien à 42 °C. La croissance est rapide sur les milieux ordinaires et les colonies obtenues après 24 heures d'incubation sur gélose nutritive sont petites, rondes, bombées, blanchâtres et d'un diamètre de 2 à 3 mm. Après 48-72 heures d'incubation, les colonies s'agrandissent (diamètre de 5 à 10 mm), elles sont opaques, de couleur crème et dégagent une odeur de terre ou de truffe. Fréquemment, une dissociation entre colonies lisses (S) et celles rugueuses (R) ayant un aspect plissé, ridé et ombiliqué est observé.
Cultures sur le milieu de Mueller-Hinton à 37°C après 30 h (haut, milieu) et 72 h (bas)

. Les autres caractères majeurs d'orientation sont: catalase +, oxydase +, aérobie stricte mais capable de croître en anaérobiose en présence de nitrate ou d'arginine (respiration anaérobie comme P. aeruginosa), ADH +, gélatinase +, acidifiant le glucose et le galactose, accumulant du poly-bêta-hydroxybutyrate comme matériel de réserve. Le "chromosome" héberge des séquences d'insertion identiques à celles retrouvées chez B. cepacia. D'autres caractères bactériologiques sont rapportés par ailleurs :
5. HABITAT
Cette espèce comme B. thailandensis est présente dans le sol (boue, sédiments) et dans les eaux (mares, marigots, rizières.......) en zone tropicale. Ces bacilles hydro-telluriques peuvent aussi vivre en dehors de ces régions tropicales et résistents très bien au froid. L'eau douce dans laquelle sont exportés des poissons exotiques peut être contaminée ayant pour conséquence, une contamination des aquariums.
6. POUVOIR PATHOGENE
. Pratiquement tous les mammifères, dont l'homme, sont sensibles: domestiques (chevaux, petits ruminants, porcs, bovidés, camélidés, lapins, carnivores ...) ou sauvages (éléphant, mouflons, oryx, patas, callitriche, cerf sika, tatou, rongeurs sauvages, cob, buffle, dauphins, ...). De nombreuses espèces d'oiseaux (pigeon, oie, pingouins, ...) sont moins sensibles.
. La source de contamination est le milieu extérieur mais l'homme peut se contaminer à partir d'un animal infecté (zoonose rare).
. Les principaux modes de contamination sont l'infection de plaie souillée par de la terre (blessure de guerre, accident du travail en milieu rural ou piqûre réalisée par un aiguille à injection souillée lors de toxicomanie) ou plus rarement, inhalation de poussières contaminées (exemple des soldats ayant participé à la guerre du Viêt-nam lors d'embarquement sur hélicoptère). Enfin les autres voies de contamination sont l'ingestion et la voie sexuelle.
. Des facteurs prédisposants ont été identifiés chez l'homme tels alcoolisme, déficit immunitaire, diabète de type II, insuffisance rénale, cancer...... .
. La maladie peut atteindre les personnes de tout âge mais les manifestations cliniques présentent certaines différences entre les adultes et les enfants.
. Après contamination, les symptômes apparaissent après un temps de latence plus ou moins prolongé (de 24 h à quelques dizaines d'années).
. L’évolution spontanée en l’absence de traitement est mortelle dans la très grande majorité des cas.
. Une rechute est toujours possible, aussi les symptômes sont susceptibles de réapparaître plusieurs années après une apparente guérison.
. L'expression clinique est très polymorphe ("the great mimicker") avec les principales formes cliniques suivantes :
|
Formes aiguës septicémiques
|
|
Formes pulmonaires aiguës
|
|
Infections localisées et abcès
|
|
Formes chroniques
|
|
Formes latentes
|
- Formes aiguës septicémiques : Le délai d’incubation se situe entre 1 et 21 jours (moyenne de 9 jours). Celui-ci semble influencé par divers facteurs tels mode de contamination, importance de l’inoculum, virulence de la souche et enfin les facteurs de risques associés.
Selon Currie en Australie, 88% des cas évoluaient sur le mode aigu, soit 12% sur le mode chronique, et 85% des cas surviennent durant la saison des pluies (novembre-mai).
. Le début est le plus souvent brutal: syndrome fébrile évoluant depuis quelques jours, avec parfois des signes d’une mélioïdose localisée (pulmonaire le plus fréquemment). Ce syndrome peut débuter dans la journée suivant le contage. L’examen clinique retrouve en 48 heures des signes généraux: hyperthermie ou au hypothermie, tachycardie et/ou hypotension, prostration, douleurs thoraciques, toux avec parfois hémoptysies. Ce tableau est accompagné d’une défaillance multiviscérale (ictère cutanéo-muqueux, insuffisance respiratoire et rénale avec oligoanurie). La forme aiguë fulminante avec tableau de choc septique et défaillance multiviscérale a une létalité quasi-totale.
. Enfin, de nombreuses autres localisations sont retrouvées : pulmoniares (pneumonie), cutanées, abcès intra-abdominaux, urinaires (abcès rénaux, orchite, prostatite, pyélonéphrite), arthrites, pleurésies, ORL, diarrhées et douleurs abdominales, localisations neurologiques, péricardite.....Une pathologie sous-jacente est associée dans 70 à 90% des cas de septicémie.
- Formes pulmonaires aiguës : L’atteinte pulmonaire est la présentation clinique la plus fréquente et le plus souvent secondaire (mais pas uniquement) à la contamination par voie hématogène. Cette forme est la plus souvent rencontrée en zone endémique. Il faut savoir l’évoquer chez un patient ayant séjourné en zone d’endémie, d'où l’importance de l’interrogatoire exhaustif du patient (cf alerte au tsumani).
Cliniquement, on retrouve: hyperthermie, prostration, dyspnée, douleurs thoraciques de type pleural. Une toux, des crachats purulents, voire une hémoptysie y sont associées.
Radiologiquement, on retrouve des infiltrats parenchymateux bilatéraux non systématisés; puis apparaissent des images d’excavation très similaires à celles de tuberculose.
. L’association avec un épanchement pleural est fréquente, les pleurésies purulentes ayant tendance à s’enkyster avec des risques de pneumothorax ou de pyopneumothorax. Un épanchement péricardique, bien que plus rare, peut se rencontrer.
- Infections localisées et abcès : Les manifestations cutanées aiguës accompagnent les formes septicémiques: rash maculo-papuleux, urticaire, pustules ou d’abcès sous-cutanés. On connaît des dermites prurigineuses fébriles des riziculteurs. Sont aussi rapportées des lymphangites, lymphadénites, cellulites. L’évolution peut aller vers l’ulcération ou, plus rarement, vers un ecthyma gangrenosum. On peut voir également une atteinte cutanée granulomateuse chronique. Tous les viscères peuvent être touchés avec parfois de volumineux abcès (foie, rate +++). Ces atteintes ont un aspect clinique non spécifique et peuvent accompagner un état septique ou être complètement isolées.
- Formes chroniques : Les manifestations chroniques de la maladie doivent être évoquées chez tout patient vivant ou ayant séjourné en zone d’endémie et même après de nombreuses années.
Elle peuvent débuter uniquement par une fièvre au long cours et une altération de l’état général. On peut retrouver toutes les manifestations décrites ci-dessus avec notamment, la présence d’abcès profonds sur un mode d’évolution chronique et des adénopathies périphériques. Les formes pulmonaires chroniques peuvent évoluer sur plusieurs années avec un aspect de tuberculose ou de sarcoïdose. La confusion entre cette dernière et la mélioïdose entraîne un risque majeur, car la mise en route d’une corticothérapie aggraverait considérablement la pathologie infectieuse.
Dans 90% des cas, on constate une altération de l’état général, un amaigrissement, une fébricule et une toux ; dans 50%, des douleurs thoraciques; dans 30%, une hémoptysie et 5%, seulement une hépato-splénomégalie.
- Formes latentes : Elles sont définies par une sérologie positive sans manifestation clinique apparente (test d’hémagglutination indirecte avec détection d’anticorps spécifiques de type IgG). Il s’agit d’un portage asymptomatique de B. pseudomallei. Ces formes sont donc seulement connues en zone d’endémie. Cette séropositivité témoigne de la présence du germe à l’état quiescent dans l’organisme qui peut se manifester à tout moment lors de dysfonctionnement physiologique avec déséquilibre immunitaire (diabète, cancer, maladie hématologique…). La maladie aiguë se déclenche alors, ces formes patentes pouvant se déclarer jusqu’à 25 ans plus tard.
225.000 des 2,5 millions de soldats américains ayant séjourné au Vietnam pendant la guerre auraient contracté une forme latente.
|
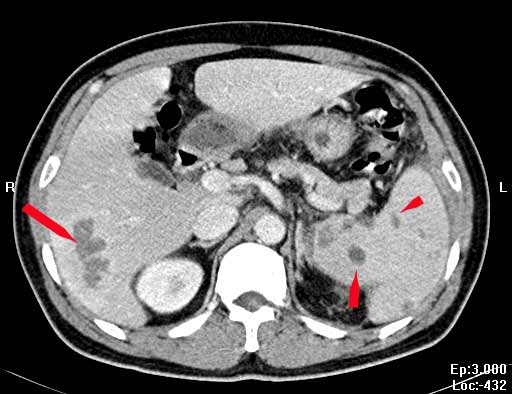
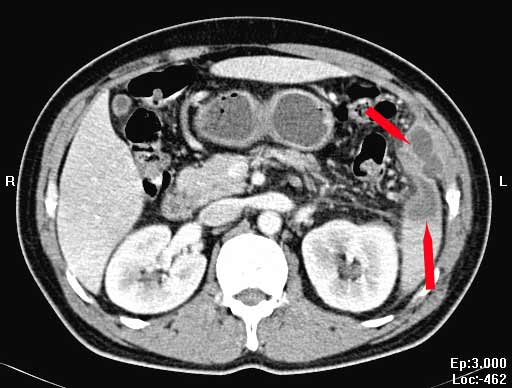
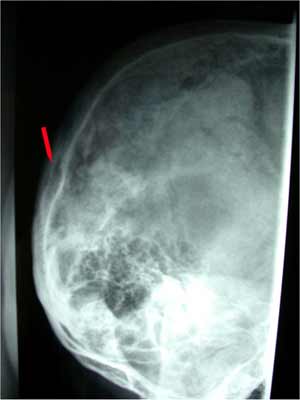
Scanner thoraco-abdominal à J3 chez un malade diabétique de 47 ans d’origine Cambodgienne traité sans succès pour une tuberculose pulmonaire et arrivé au urgences pour tuméfaction douloureuse du cuir chevelu au niveau occipital, douleurs abdominales insomniantes, fièvre persistante (38.5°-39°C), amaigrissement de 5 kg, traitement par AINS sans efficacité (Hôpital Saint-Antoine, 2004).
Radiographie du crane du malade
|
Aspects cliniques de la mélioidose
(Cheng A.C. Currie B. J. Clin. Microbiol. Rev. 2005)
|
Clinique
|
Hôpital Royal Darwin (1989-99)(331 cas)
|
Hôpitaux thaïlandais (1078-85)(686 cas)
|
| Pneumonie, pleurésie |
58 %
|
45 %
|
| Génito-urinaire |
19 %
|
7 %
|
| Tissus mous |
17 %
|
13 %
|
| Inf. neurologiques/abcés cerveau |
4 %
|
3 %
|
| Rate (abcès) |
4 %
|
2 %
|
| Foie (abcès) |
2 %
|
7 %
|
| Forme intra-abdominale |
3 %
|
5 %
|
| Prostate (abcès) |
18 % (homme)
|
0,3 %
|
| Parotide (abcès) |
-
|
2 %
|
| Os, articulation |
4 %
|
5 %
|
| Bactériémie |
46 %
|
58 %
|
| Mortalité |
19 %
|
38-61 %
|
7. PHYSIO-PATHOGENIE
. B. pseudomallei est une bactérie intracellulaire facultative dont les facteurs de pathogénicité restent mal connus. L'endotoxine montre les activités biologiques classiques. La fraction polysaccharidique du LPS est constituée de deux chaînes différentes (O-PSI et O-PSII) présentes en quantités à peu près égales. Les anticorps, notamment contre le composant O-PSII, jouent un rôle protecteur, en facilitant la phagocytose. La capsule polysaccharidique joue probablement un rôle antiphagocytaire permettant au bacille de survivre dans les macrophages et autres cellules phagocytaires de l’hôte.Un exopolysaccharide de masse moléculaire (>150 kDa) produit constitutivement aide à former une barrière protectrice.
. Cette bactérie active le complément par la voie alterne et celle classique. Les opsonines C3b et iC3b permettent l'ingestion de la bactérie par les granulocytes neutrophiles et les macrophages. Celle-ci n'est pas suivie de la lyse bactérienne, le germe restant présent dans une vacuole et pouvant se multiplier.
. Suite au séquençage du génome composé de 2 chromosomes, on a mis en évidence la capacité de la bactérie de sécréter des exotoxines: protéases, lécithinases, lipases, catalases et hémolysines, capables d’endommager les cellules de l’hôte.Toutes ces substances ont des propriétés biologiques avec pour conséquences: nécrose tissulaire, hémolyse et cytolyse. Parmi les autres toxines produites, citons la toxine thermolabile, de composition chimique inconnue, létale pour la souris et le hamster, douée d'un fort pouvoir anti-coagulant. Une autre toxine thermolabile, enzyme protéolytique probable, est aussi excrétée par les bactéries en culture. Elle a une activité dermonécrotique pour le cobaye. Un glycolipide de 762 Da, excrété par le germe et à activité hémolytique, est toxique pour les cultures cellulaires. Il agirait à la manière d'un détergent. Une toxine cytoléthale (Cytolethal toxin ou CLT) a pu être isolée. Celle-ci aménerait à une mélioïdose avec septicémie.
. Parmi, les autres facteurs de virulence, une exotoxine protéique de 31.000 de poids moléculaire produite in vitro et in vivo, inhibe la synthèse protéique et celle de l'ADN des macrophages lors de culture. Une métalloprotéase de 36.000 de poids moléculaire est excrétée in vitro et in vivo. Elle est capable de dégrader le C3, les IgG, les IgA et donc d'inhiber les moyens de défense de l'organisme. Son action protéolytique sur la transferrine et l'hémoglobine participerait à l'acquisition du fer et celle sur le collagène et l'élastine jouerait un rôle dans la diffusion de la bactérie. Enfin la malléobactine, sidérophore (de type hydroxamate), de 1.000 Da (PM) est apte à capter plus efficacement le fer lié à la transferrine que celui lié à la lactoferrine.
. La mélioïdose septicémique est associée à la production de cytokines et à une importante réaction inflammatoire. De grandes concentrations de cytokines pro et anti-inflammatoires sont trouvées: Tumour Necrosis Factor (TNF), interleukine-6, interleukine-10, interféron g et interleukine-18 sont tous augmentés.
8. EPIDEMIOLOGIE
Cette bactérie tellurique et hydrique se rencontre essentiellement entre les 20ème parallèles nord et sud avec une nette prédominance pour le sud-est asiatique et le nord de l'Australie.
Il s'agira en France de la découverte fortuite de quelques cas annuels de malades originaires d'une région d'endémie mais installés depuis plusieurs années ou de coopérants présentant des facteurs de risque tels diabète, alcoolisme...........
Pour en savoir plus: Cheng A.C. Currie B. J. Clin. Microbiol. Rev. 2005.
9. DIAGNOSTIC BACTERIOLOGIQUE
* Commémoratifs
La mélioïdose doit être prise en compte dans le cadre du diagnostic différentiel d'un patient présentant une fièvre d'origine inconnue avec ou sans foyer, ayant voyagé, même s'il y a plusieurs années dans des régions chaudes et humides, surtout Sud-Est Asiatique avec la Thaïlande, l'Inde, le Vietnam, ou encore Hong-Kong au cours d'un voyage d'agrément ou à titre de coopérant. Ne pas oublier certains pays d'Afrique et des Caraïbes.
Il s'agira souvent d'un patient immunodéprimé (état diabétique, alcoolisme, VIH + .......), d'origine asiatique (Cambodgien, Vietnamien)
. Le diagnostic clinique est malaisé, du moins en France en raison de sa rareté. on pensera aux formes aiguës septicémiques avec constitution d'abcès viscéraux. L'évolution vers la mort (50-90 %) dépendra du traitement entrepris. On pourra y songer devant une forme pulmonaire de type tuberculose ou encore devant une forme chronique avec images d'infiltrats pulmonaires diffus, une pneumonie atypique, une arthrite, une ostéite fistulisée, ou encore un abcès intramusculaire.

DEVANT TOUTE SUSPICION, PREVENIR LE LABORATOIRE

* Prélèvements : Dans le cadre d'un état septicémique, d'une tuberculose, d'une arthrite ..... seront adressés au laboratoire : hémoculture, expectoration, liquide articulaire, liquide pleural, liquide de lavage broncho-alvéolaire ..............
* Aspects morphologiques : La coloration de Gram permet de caractériser un petit bacille à Gram négatif (de 0,5 à 2 mm de long) de type Pseudomonas avec une tendance marquée à la coloration bipolaire.
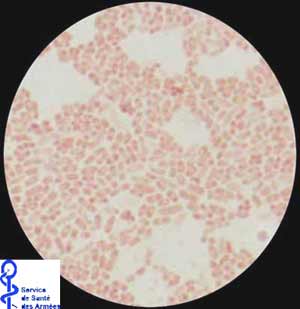
. Cette espèce est très mobile grâce à la présence de plusieurs flagelles polaires (contrairement à B. mallei qui n’en possède pas). Enfin, une capsule et des inclusions de poly-b-hydroxy- butyrate sont observées dans le cytoplasme (caractère non recherché en routine).
* Aspects culturaux : Cette espèce pousse facilement à 37°C en 24-48 h en atmosphère ambiante sur les milieux de culture d'usage courant tels bouillons commerciaux pour hémoculture, gélose au sang frais, gélose chocolat, gélose trypticase soja ou encore milieu de Mueller-Hinton. La culture peut aussi s'obtenir à 20°C.
Exemples d'aspect de culture
 |
 |
Lors de contamination des prélèvements par une flore associée (aspirations trachéo-bronchiques), ou à partir d'échantillons du sol, l'emploi de milieux sélectifs est possible. B. pseudomallei et B. thailandensis ont des caractères phénotypiques très voisins mais sur le milieu sélectif de Ashdown, les colonies de B. pseudomallei sont rugueuses et pigmentées en pourpre foncé (ci-dessous), celles de B. thailandensis étant lisses et rose:
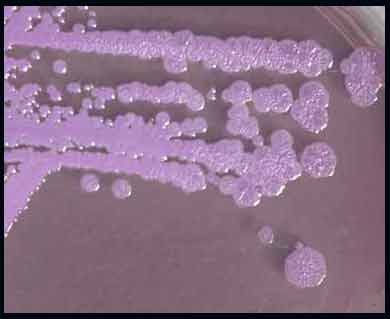
http://www.hpa.org.uk/infections/topics_az/deliberate_release/Glanders/homepage.asp#row2
Ce milieu sélectif, surtout utilisé en zone endémique, comporte du glycérol, du cristal-violet, du rouge neutre et de la gentamicine ou encore après modification, de la colistine:
http://www.bacterio.cict.fr/bacdico/bb/pseudomallei.html
Autre milieu sélectif : Celui de Galimand-Dodin est un milieu minimum contenant de la thréonine pouvant être supplémenté avec de la colistine (50 mg/l)(résistance naturelle).
|
FRENCH SNIFFING !
L' odeur de terre ou de truffe est caractéristique. Mais compte tenu du danger lié à l'inhalation du germe, l'odeur sera seulement recherchée sans ouvrir la boîte.imgburk/carte.jpg |
 |
* Autres caractères d'identification
Si l'aspect des colonies est non caractéristique, celui observé sur une gélose de Drigalski oriente immédiatement sur un bacille à Gram-négatif aérobie non fermentaire (petites colonies lactose-négatif après 24 h d'incubation entre 20 et 37°C).

Aussi sera recherchée l'oxydase, voire la catalase qui est faible.

Dans la pratique d'un laboratoire de bactériologie médicale, sera souvent ensemencée, en première intention, une galerie API 20E qui oriente rapidement (24 h) vers une souche de P. aeruginosa compte tenu des caractères suivants: ADH +, CIT +, gélatinase +, NO3 +, "non fermentaire". L'antibiogramme, obtenu dans le même laps de temps, sera très contributif au diagnostic (cf plus loin):


En deuxième intention, sera ensemencée une galerie API 20NE, lue après 48 heures d'incubation à 30°C, permettant d'obtenir les résultats suivants :

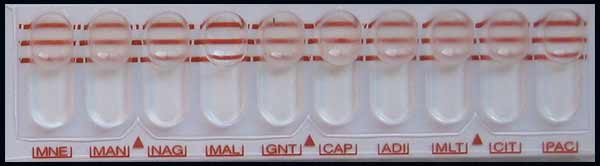
- Caractères positifs : réduction des nitrates, ADH, gélatinase, assimilation de substrats (glucose, mannose, mannitol, N-acétyl-glucosamine, gluconate, caprate, adipate et malate).
- Caractères négatifs : glucose (fermentation), uréase, indole, ONPG, assimilation du maltose (5 % +).
- Caractères variables : esculine (nombreuses souches hydrolysant l'esculine lors l'incubation prolongée > 48 heures), arabinose, citrate et phényl-acétate.
* Autres caractères de confirmation pouvant être recherchés :
. la respiration des nitrates ou respiration anaérobie (milieu mannitol-mobilité, par exemple).
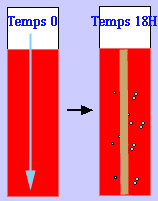

. la culture en milieu liquide (bouillon coeur-cervelle, bouillon nutritif.....) avec l'aspect d'un germe aérobie strict avec un voile. Dans un bouillon peptoné, un trouble apparaît en surface puis descend progressivement tandis qu'un voile plissé et fragile se développe en surface.

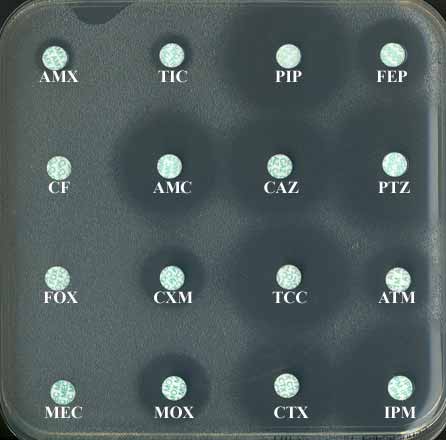
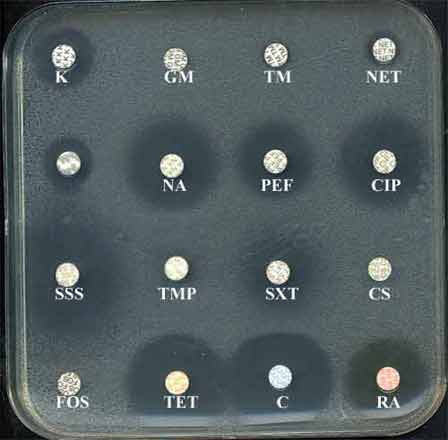
. l'antibiotype (cf antibiogramme): On notera sa résistance naturelle aux polymyxines dont la colimycine (CS), aux aminosides telles la kanamycine (K), la gentamicine (GM), la nétilmicine (NET) ou encore la tobramycine (TM).

Le phénotype de résistance naturelle aux B-lactamines peut aussi être très utile pour l'identification. Il sera analysé plus loin.
10. DIAGNOSTIC GENOMIQUE
Des techniques de détection rapide du germe par la réaction de polymérase en chaîne (PCR) et par hybridation sont utilisées dans des régions ou pays de forte endémicité ou encore par séquençage du gène codant pour l'ARNr 16S. B. thailandensis isolée dans le Centre et le Nord-Est de la Thaïlande semble non pathogène mais est proche génomiquement de B. pseudomallei.
11. DIAGNOSTIC SEROLOGIQUE
Il est de peu d'intérêt sous nos latitudes en raison de la rareté de cette affection. Diverses techniques sont utilisées telles agglutination, hémagglutination passive, fixation du complément, ELISA, mise en évidence des IgM par immunofluorescence ou immunoenzymologie.... ou par une technique utilisant des anti-IgM marquées par l'or colloïdal. Mais elles manquent de spécificité et/ou de sensibilité. En zone d'endémie, la recherche d'IgM peut permettre de différencier les infections actives des infections latentes/chroniques.
 |
Pour envoyer les souches : Dr Francois THIBAULT Centre de recherches du service de santé des armées Département de biologie des agents transmissibles B.P. 87 F-38702 La TRONCHE Cedex FRANCE Tel.: 04 76 63 69 20 Fax.: 04 76 63 69 17 Courriel: fthibault@crssa.net |
. Les conditions habituelles d'un antibiogramme conviennent, à savoir: Milieu de Mueller-Hinton normal durant 20 à 24 h d'incubation à 37°C.
. Phénotype sensible
- On notera, avant tout, sa mutirésistance naturelle aux polymyxines dont la colimycine (CS), aux aminosides telles la kanamycine (K), la gentamicine (GM), la nétilmicine (NET) ou encore la tobramycine (TM) et enfin à certaines B-lactamines dont les pénicillines (amoxicilline, ticarcilline) et les céphalosporines de première ou deuxième génération mais une grande sensibilité à d'autres telles la ceftazidime. Attention, il y avoir sensibilité à la kanamycine.
- Cette espèce est sensible aux associations amoxicilline (AMX) ou ticarcilline (TIC) et acide clavulanique (AMC, TCC), définissant ainsi un phénotype "pénicillinase de bas niveau". Les autres antibiotiques actifs sont peu nombreux, classiquement le chloramphénicol (C), les tétracyclines (TET) et l'association triméthoprime-sulfaméthoxazole (SXT). Enfin l'activité antibactérienne in vitro des fluoroquinolones dont la ciprofloxacine (CIP) apparait médiocre. Parmi les ß-lactamines actives, il convient de citer les C3G dont la ceftazidime (CAZ).
|
Antibiotique
|
CMI 50%
|
CMI 90%
|
| Amoxicilline |
> 64
|
> 64
|
| Amoxicilline + Ac. clavulanique |
> 64
|
> 64
|
| Pipéracilline |
1-4
|
2-8
|
| Pipéracilline + Tazobactam |
1
|
1
|
| Ticarcilline |
128-256
|
128->256
|
| Ticarcilline + Acide clavulanique |
4-16
|
4-16
|
| Céfalotine |
> 64
|
> 64
|
| Céfamandole |
> 64
|
> 64
|
| Céfuroxime |
16-64
|
32->64
|
| Céfixime |
2
|
4
|
| Ceftazidime |
0,7-2
|
1-4
|
| Céfotaxime |
2-4
|
3-8
|
| Céfépime |
12,5
|
12,5
|
| Latamoxef |
8
|
16
|
| Aztréonam |
4-16
|
8-32
|
|
Imipénème
|
0,4-0,5
|
0,8-1
|
| Méropénème |
0,8-1
|
0,8-1
|
| Kanamycine |
8
|
32
|
|
Gentamicine
|
32
|
64
|
| Tobramycine |
-
|
-
|
| Nétilmicine |
-
|
128
|
| Amikacine |
32
|
64
|
|
Acide nalidixique
|
25
|
50
|
|
Ciprofloxacine
|
2-4
|
3-8
|
| Tétracycline |
4-6
|
8-16
|
| Doxycycline |
0,5-5
|
1-8
|
| Chloramphénicol |
6,3-16
|
6,3-32
|
| Sulfamides |
16-50
|
50->64
|
| Triméthoprime |
16-25
|
25->64
|
|
Cotrimoxazole
|
1/19-5/25
|
2/28->64
|
| Colistine |
-
|
-
|
| Rifampicine |
8-25
|
16-64
|
| Fosfomycine |
>200
|
>200
|
Selon Cheng A.C. Currie B.J. Clin. Microbiol. Rev. 2005, 383-416.
. Le traitement classique de plusieurs mois (6 à 12) fait appel au chloramphénicol, aux tétracyclines (doxycycline) ou à l'association triméthoprime-sulfaméthoxazole (cotrimoxazole), mais à la phase d'éradication. De nombreuses données comparatives d'essais cliniques permettent de mieux préciser celui-ci, en particulier, pour le traitement d'attaque par voie parentérale, lié à la prescription d'une ß-lactamine (ceftazidime, 7-15 jours). D'autres antibiotiques étaient ou sont potentiellement intéressants comme l'imipénème, la pipéracilline ou encore les associations amoxicilline-acide clavulanique, ampicilline-sulbactam ou mieux céfopérazone-sulbactam. Cependant l'émergence de la résistance est bien réelle et demande une surveillance du traitement. L'experience sur l'association doxycyline - ceftazidime est limitée lors du traitement initial.
http://umvf.cochin.univ-paris5.fr/article.php3?id_article=1001
http://www.eurosurveillance.org/em/v09n12/0912-138.asp
http://www.eurosurveillance.org/em/v10n03/1003-126.asp?langue=01&
- Après traitement par ceftazidime, la résistance peut quelquefois apparaitre chez les malades. Elle est identifiée par une synergie entre la ceftazidime et l'acide clavulanique. Après traitement par l'Augmentin®, la résistance à cette association peut aussi apparaitre. Celle-ci est croisée avec le Timentin® ainsi que vis-à-vis de certaines céphalosporines (céfotaxime, ceftriaxone).
- Au plan du mécanisme, le phénotype de résistance naturelle aux ß-lactamines est lié à la présence d'une ß-lactamase chromosomique de la classe A, peu inductible de type céfuroximase avec inactivation des pénicillines (amino et carboxypénicillines) et de certaines céphalosporines (céfalotine, céfaloridine, céfuroxime......). Cette enzyme chromosomique (BPS-1) peut être hyperproduite ou évoluer par mutation aussi in vitro qu' in vivo pour engendrer la résistance soit aux C3G, soit aux associations de l'acide clavulanique avec une pénicilline.
Quelques adresses:
http://www.chu-rouen.fr/navimesh/M/navimelioidose.html
http://www.phac-aspc.gc.ca/msds-ftss/msds26f.html
http://www.astrium.com/melioidose-preambule.html (thèse de Houssaint C., 2003)
http://www.oie.int/search/search.asp
http://www.pasteur.fr/sante/clre/chap/envois/frame-a.html
http://www.inspection.gc.ca/francais/sci/ahra/rianfrwk/appf.shtml
http://www.snfge.asso.fr/02-Connaitre-maladie/0F-foie-et-voie/faq/foie_abces.htm
http://www.cdc.gov/ncidod/eid/vol7no3/hsueh.htm
http://www.hpa.org.uk/infections/topics_az/deliberate_release/Glanders/homepage.asp
Revue générale récente:
Cheng A.C. Currie B.J. Melioidosis: Epidemiology, pathophysiology and management. Clin. Microbiol. Rev. 2005, 383-416.
Cette fiche a été préparée par le Professeur A. PHILIPPON (Faculté de Médecine Paris V, Université René Descartes) et le Docteur V. LALANDE (Faculté de Médecine Saint-Antoine, Université Paris VI): Première version (05.06.99), deuxième (25.08.05)
|
|
|
|
|