LEGIONELLA

|
Comment définir une légionellose ? |
1 - Introduction
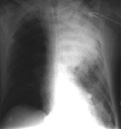
La légionellose, infection provoquée par des bactéries du genre Legionella, est une étiologie commune de pneumonies communautaires et nosocomiales. Les légionelles sont des bactéries intracellulaires facultatives à Gram négatif, à tropisme hydrique, largement répandues dans la nature. Elles sont présentes dans les écosystèmes naturels et les réseaux de distribution d'eaux. L’homme se contamine par inhalation d’aérosols contaminés. Aucun argument clinique et radiologique ne permet de différencier avec certitude les légionelloses des autres étiologies de pneumonie. Le diagnostic de certitude reposera sur la présence d’une pneumonie associée à des critères biologiques précis. La plupart des cas sont sporadiques, mais Legionella est également associée à des épidémies d’origine communautaire ou nosocomiale. La mortalité importante (20%) est dépendante notamment de la précocité de la mise en route d'une antibiothérapie adaptée. Le diagnostic doit être le plus rapide possible et la déclaration de chaque cas est obligatoire pour permettre de détecter précocement les cas groupés. Le diagnostic de la maladie est facilité par la détection rapide d’antigènes urinaires spécifiques de Legionella pneumophila sérogroupe 1. La mise en culture systématique de prélèvements cliniques est primordiale lors de la suspicion d'un cas de légionellose, car seul l'isolement d'une souche clinique permettra par l'utilisation d'outils moléculaires de comparer cette souche aux souches isolées de l'environnement et ainsi confirmer la source de la contamination.
2 - Habitat
| Les légionelles sont des bactéries d’origine hydrotellurique. Elles sont présentes à l’état naturel dans les eaux douces (lacs et rivières) et les sols humides. A partir du milieu naturel, la bactérie colonise les sites artificiels lorsque les conditions de son développement sont réunies (température inférieure à 50°C, bras morts, présence de biofilm, présence d’autres |
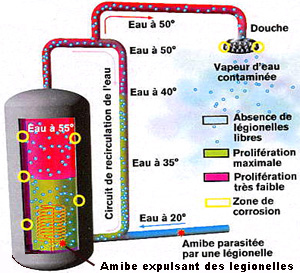 |
| microorganismes des milieux aquatiques comme les cyanobactéries ou les amibes libres ou présence de certains matériaux tel que fer, zinc, PVC). Exemple: cumulus..... |
|
| Les systèmes de climatisation sont également contaminés par des légionelles. Tous les éléments constitutifs ou annexes de ces systèmes qui comportent de l'eau stagnante (tours aéro-réfrigérantes, humidificateurs, bacs de réserve d'eau...) et qui génèrent de la vapeur et des condensations sont des réservoirs potentiels de Legionella. |
 |
 |
| Les autres sources possibles sont par exemple les piscines et les bains à remous, les équipements des stations thermales, les fontaines et dans les hôpitaux : |
 |
 |
| les humidificateurs, les respirateurs et les nébulisateurs lorsqu'ils sont alimentés par l'eau du réseau. |
||
3- Caractéristiques bactériologiques
Les légionelles sont des bacilles à Gram négatif (faiblement colorés), non sporulés, non acidorésistants, non capsulés, de 0,3 à 0,9 µm de large sur 2 à 20 µm de long.
Les légionelles forment une famille comportant 46 espèces et 64 sérogroupes : Toutes ses espèces ont été isolées au moins une fois dans l’environnement, une vingtaine d’espèces ont été isolées au moins une fois en clinique humaine (L. anisa, L. longbeachae, L. micdadei, L. jordanis, L. bozemanii, L. dumoffii ...), L. pneumophila est l’espèce la plus importante en pathologie humaine et elle est responsable de plus de 95 % des légionelloses,
L. pneumophila sérogroupe 1 est associé à plus de 80 % des cas.
4 - Pouvoir pathogène : LA LEGIONELLOSE
I - Manifestations cliniques des légionelloses
Les légionelloses incluent 3 formes cliniques distinctes provoquées par des bactéries du genre Legionella :
- la légionellose ou maladie des légionnaires
- la fièvre de Pontiac
- les formes extra-pulmonaires
La fièvre de Pontiac est un syndrome pseudo-grippal de guérison spontanée en 2 à 5 jours. La période d’incubation est de 1 à 2 jours avec un taux d’attaque important de 90 %. Cette infection n’est jamais mortelle. Elle est exceptionnellement diagnostiquée et la bactérie n’est jamais isolée de prélèvement pulmonaire.
Les formes extra-pulmonaires sont exceptionnelles. Le site extrapulmonaire le plus fréquent est le cœur avec des manifestations sous forme de myocardite, péricardite ou endocardite sur valve prothétique.
La légionellose proprement dite ou maladie des légionnaires est caractérisée par une pneumonie aiguë.
Après une période d’incubation de 2 à 10 jours, les patients présentent un syndrome pseudogrippal avec une fièvre, une toux sèche, des céphalées, des myalgies, de l’anorexie. A la phase d’état, le tableau associe une fièvre élevée, une dyspnée et une toux importante pouvant s’accompagner d’expectorations. La pneumonie est souvent associée à des signes digestifs à type de diarrhée ou à des signes confusionnels. Elle peut s'accompagner dans les formes sévères de signes de défaillance multiviscérale. La mortalité est d'environ 20%.
Anomalies biologiques non spécifiques
De nombreuses anomalies biologiques non spécifiques témoignent du caractère systémique de cette pathologie. Il est fréquent d'observer une hyperleucocytose ou plus rarement dans les cas sévères une leucopénie et une thrombocytopénie. D'autres anomalies témoignent d'une atteinte rénale (protéinurie, hématurie, hyponatrémie et hypophosphatémie) ou d'une atteinte hépatique (élévation de l'aspartate aminotransférase, des phosphatases alcalines et de la lacticodéshydrogénase). L’élévation des CPK signe la présence d’une rhabdomyolyse. L'hypoxémie est souvent proportionnelle au degré d'atteinte des poumons.
Aucun argument clinique et radiologique ne permet de différencier avec certitude les légionelloses des autres étiologies de pneumonie, notamment des pneumonies à pneumocoque. Le diagnostic de certitude de légionellose repose sur des examens bactériologiques spécifiques.
|
Maladie des légionnaires
|
Fièvre de Pontiac
|
Localisations extrapulmonaires
|
|
| mortalité |
20% | 0% | Atteintes hématologiques |
| période d'incubation |
2-10 jours | 1-2 jours | Atteintes neurologiques |
| symptomes |
fièvre, toux, myalgie, céphalée, douleur thoracique, diarrhée, confusion | syndrome grippal : fièvre, toux, myalgie | Atteintes cardiaques myocardite, péricardite, endocardite |
| poumon | pneumonie, pleurésie, abcès pulmonaire |
pas de pneumopathie, pas d'abcès pulmonaire
|
|
| rein | désordres rénaux : protéinurie, hématurie, insuffisance rénale | pas de manifestations | Atteintes musculaires, rhabdomyolyse |
| foie | peu d'anomalies de la fonction hépatique | pas de manifestations | |
| tractus gastrointestinal | diarrhée aqueuse, douleur abdominale, nausées, vomissements | pas de manifestations | localisations digestives rétinite, sinusite |
| système nerveux central | somnolence, délire, désorientation, confusion | pas de manifestations |
II - Notions épidémiologiques
La légionellose est une maladie à déclaration obligatoire
Pour chaque cas une double déclaration est réalisée par le clinicien et par le biologiste (JO n° 110 du 13 mai 1999 page 7095) à la DDASS du département d'hospitalisation.
La fiche de déclaration obligatoire est disponible à l'adresse suivante : http://www.invs.sante.fr.
Pour chaque cas de légionellose diagnostiqué, il faut interroger le malade ou sa famille sur les sites que le patient a fréquenté dans les 2 à 10 jours (correspondant à la période d’incubation) précédant l'apparition des signes cliniques. Tous ces lieux (noms des hôtels en cas de voyage, des hôpitaux, des stations thermales, etc.) doivent apparaître sur la déclaration. Si le nom du même lieu apparaît sur deux déclarations, une suspicion de cas groupés ou liés sera immédiatement évoquée.
| Les principales caractéristiques épidémiologiques des légionelloses déclarées en France sont décrites par l'Institut de Veille Sanitaire dans différents Bulletin Epidémiologique Hebdomadaire disponibles à l'adresse suivante : http://www.invs.sante.fr. http://www.eurosurveillance.org/ |
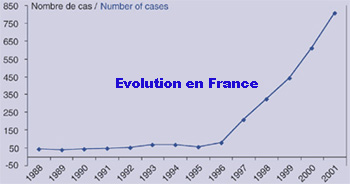 |
Fréquence
| 2 à 15 % des pneumonies communautaires nécessitant une hospitalisation |
| 3ème ou 4ème rang des étiologies des pneumonies hospitalisées |
| 807 cas déclarés en France en 2001 |
| estimation : plus de 1200 cas diagnostiqués par an en France |
| Globalement 1 cas pour 100 000 habitants par an en France |
| 80 % des cas sont communautaires (20 % des cas sont nosocomiaux) |
Facteurs de risque
Les légionelloses s’observent toute l’année avec un pic saisonnier en été et à l’automne. Les facteurs de risque les mieux identifiés sont l’âge (supérieur à 50 ans), le sexe (masculin), le tabagisme et l’éthylisme...
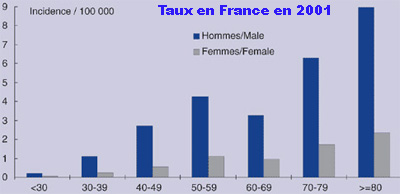 |
..ou encore les traitements immunosuppresseurs et les maladies sous-jacentes, ainsi que l’exposition plus ou moins prolongée ou fréquente à des sources de contamination (voyages, hôtels, centres de loisirs ou de soins…). L'âge médian des cas est de 58 ans (extrêmes 17 - 98 ans). |
http://www.eurosurveillance.org/em/v07n09/0709-121.asp
Facteurs prédisposants* parmi les cas de légionellose diagnostiqués en 2001 en France
| Facteurs prédisposants |
N
|
%
|
| Cancer / hémopathie | 90 | 11 |
| Corticoïdes / immunosuppresseurs | 98 | 12 |
| Diabète | 78 | 10 |
| Tabac | 319 | 40 |
| Autres | 170 | 22 |
| > 1 facteur | 557 | 69 |
III - Mode de contamination
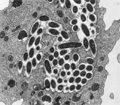
Les légionelles sont des bactéries intracellulaires facultatives, elles infestent et se multiplient dans les protozoaires libres dans l’environnement (notamment dans les amibes), dans les macrophages alvéolaires, les monocytes et les cellules épithéliales chez l’homme.
La contamination des personnes exposées se fait essentiellement par inhalation d’eau contaminée diffusée en aérosol.
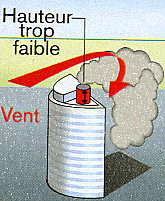
Les sources de contamination sont très variées. Les douches et les panaches des tours aéro-réfrigérantes sont les sites les plus souvent mis en cause.
| Ces aérosols atteignent les alvéoles pulmonaires (1); les légionelles infestent les macrophages alvéolaires (2), survivent et se multiplient dans les phagosomes à pH neutre (3 - 4). L’inhibition de la fusion du phagosome et des vacuoles lysosomiales permet la survie intracellulaire des légionelles et entraîne la destruction des macrophages (5). |
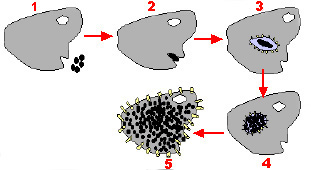 |
La dose nécessaire pour provoquer une infection chez l’homme n’est pas clairement définie. Le taux d’attaque de la maladie est faible (0,1 %). Il semble que le déclenchement d’une infection dépende de la pathogénicité de la souche, de l’état immunitaire du sujet exposé et de la concentration de légionelles dans l’eau. Certaines études épidémiologiques montrent une corrélation entre la durée d’exposition aux zones à risque et la survenue de la maladie.
La contamination par ingestion d'eau n'a pas été démontrée. L’infection directe à partir de la flore oropharyngée après intubation lors d’intervention chirurgicale, noyades ou fausse route a été suspectée.
Il n'y a pas de transmission inter-humaine.
5 - Diagnostic bactériologique
I - Quand demander un diagnostic bactériologique ?
Devant toute pneumonie accompagnée d’un des critères suivants :
| Absence d’amélioration sous traitement par ß-lactamine |
| Patient présentant un terrain favorisant |
| En situation épidémique |
| En présence d’une pneumonie nosocomiale (systématique) |
| Voyageurs |
| Exposition professionnelle à l’eau (En situation épidémique ?????) |
II- Nécessité d’un diagnostic de certitude
Le diagnostic de certitude doit être le plus rapide possible car :
la mortalité importante (20%) est dépendante de la précocité de la mise en route d'une antibiothérapie adaptée, il s’agit d’une maladie à déclaration obligatoire. Cette infection a une évolution potentiellement épidémique. Un diagnostic précoce et de certitude associé à une surveillance épidémiologique la plus réactive possible permet d'agir au plus vite sur toutes les sources de légionelles responsables de cas groupés ou liés.
Le diagnostic peut être réalisé par :
| Immunofluorescence directe |
| Mise en culture de prélèvement clinique |
| Recherche d’antigènes urinaires |
| Sérologie |
| Amplification de gènes spécifiques |
Les critères de définition des cas sont les suivants :
|
Cas confirmé
Signes cliniques et/ou radiologiques de pneumopathie associées à au moins un des critères biologiques suivants: 1 - isolement de Legionella spp. dans un prélèvement clinique |
|
Cas probable
Signes cliniques et / ou radiologiques de pneumopathie associées à un titre unique ou répété d'anticorps supérieur ou égal à 256 |
Deux méthodes sont essentielles au diagnostic des légionelloses :
| - Recherche d’antigènes urinaires de L. pneumophila sérogroupe 1
- Mise en culture de prélèvements pulmonaires |
Intérêt rapidité du diagnostic Isoler la souche clinique |
III - La recherche d’antigènes urinaire
| Intérêt et limite de la recherche d'antigènes de légionelles dans les urines La recherche d'antigènes urinaires est primordiale, car elle permet un dépistage rapide et précoce des cas à Legionella pneumophila sérogroupe 1. Les antigènes détectés sont des lipopolysaccharides de la membrane externe des légionelles. |
 |
Cinétique de l'antigénurie :
| - les antigènes apparaissent précocement : dans les 2 à 3 jours suivant l'apparition des signes cliniques chez 88 % des patients, - l'excrétion est longue et variable suivant les patients : de quelques jours à 2 mois en moyenne, et à près d'un an chez certains patients. La durée d’excrétion des antigènes peut être un facteur limitant le diagnostic de légionellose lors de pneumonie récidivante. - L'excrétion n'est pas influencée par l'antibiothérapie. |
 |
La détection des antigènes est actuellement réalisée par une méthode immunoenzymatique (ELISA) ou par une technique d'immunochromatographie sur membrane.
durée de la réaction : ELISA : 4 heures versus immunochromatographie sur membrane : 15 minutes
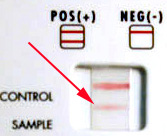 |
Performances des tests :
Spécificité : 99 % Sensibilité : 80 %. La concentration des urines avant analyse permet d’augmenter la sensibilité sans affecter la spécificité.
Valeur prédictive positive (VPP) : 86%
Valeur prédictive négative (VPN) : 95% |
Attention, seules les légionelloses à L. pneumophila sérogroupe 1 sont diagnostiqués (plus de 80 % des légionelloses)
IV - La mise en culture de prélèvements
|
Devant toute recherche d’antigène urinaire positive et en présence d’une pneumonie, la légionellose est confirmée mais l'isolement d'une souche par la mise en culture d’un prélèvement clinique reste indispensable pour l'enquête épidémiologique. |
 |
Prélèvements d’où peuvent être isolées les légionelles :
Lavage broncho-alvéolaire,
Expectoration,
Aspiration trachéale,
Aspiration bronchique,
Biopsie pulmonaire,
Liquide pleural,
Sang,
Exceptionnellement lors de légionelloses extrapulmonaires : liquide articulaire, liquide péricardique …
|
La culture des légionelles est lente (le délai de réponse est de 10 jours) et difficile. Les légionelles sont des bactéries exigeantes, nécessitant l'utilisation de milieux spécialisés. La demande de recherche de légionelles doit donc être précisée par le clinicien. Le milieu de base est le milieu BCYE (“Buffered Charcoal Yeast Extract”) contenant de la cystéine, du fer et du charbon. Les légionelles sont des bactéries aérobies strictes dont la croissance est favorisée par la présence de CO2 (2,5 %). Les colonies de légionelles présentent un aspect caractéristique dit en “verre fritté” lorsqu’elles sont observées à la loupe binoculaire (grossissement x 30). |
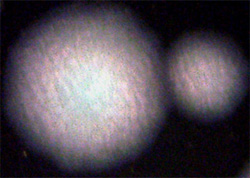 |
L’identification des colonies est réalisée par immunofluorescence directe ou par agglutination de particules de latex à l’aide d’anticorps spécifiques de la membrane externe des légionelles. La spécifité antigénique de la membrane externe est liée au lipopolysaccharide (LPS), à la protéine majeure “major outer membrane protein” (MOMP) et à d’autres antigènes protéiques. En présence de réactions croisées, des techniques de biologie moléculaire basées sur l'amplification génique (PCR) sont utilisées.
V- Examen direct des prélèvements cliniques
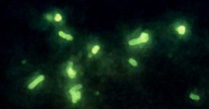 |
- Les légionelles sont des bacilles à Gram négatif faiblement colorés. La coloration de Gram réalisée sur un prélèvement pulmonaire ne permet pas d’évoquer le diagnostic. - L’examen direct des prélèvements cliniques est réalisé par immunofluorescence directe (IFD) à l’aide |
| d’anticorps monoclonaux ou polyclonaux qui reconnaissent tous les sérogroupes de L. pneumophila. Avantages : Cette technique permet un diagnostic rapide (moins de 4 heures). |
|
Inconvénients :
Sensibilité faible : 25 à 40 % avec un seuil de détection de 104 UFC/ml
Spécificité faible : 60 à 70 %, liée à des réactions immunologiques croisées avec certaines bactéries comme Pseudomonas aeruginosa, P. fluorescens, Stenotrophomonas maltophilia, Bordetella pertussis, Bacteroides fragilis et Francisella tularensis.
VI - Sérodiagnostic
La technique d'immunofluorescence indirecte (IFI) reste la méthode de référence, mais des techniques ELISA sont actuellement proposées.
Les anticorps détectés sont en majorité dirigés contre le lipopolysaccharide (LPS) de la membrane externe des légionelles. La chaine polysaccharidique est le support de l’antigénicité O et est caractéristique de chaque sérogroupe de L. pneumophila.
Les immunoglobulines totales sont détectées (IgM, IgG et IgA). Des IgM ont été détectées très tardivement chez certains patients ; leur détermination ne permet donc pas de préciser l’ancienneté de l’infection.
Seule la mise en évidence d'une augmentation du titre des anticorps (de 4 fois) permet de confirmer le diagnostic de légionellose. Pour un titre élevé précoce, la sensibilité est faible (10 %) avec une VPP extrêmement basse de 15 %.
Cinétique des anticorps :
Les anticorps apparaissent le plus souvent une semaine après le début de l'affection, le pic étant atteint trois à quatre semaines plus tard. Il existe néanmoins de grandes variations selon les malades. La séroconversion peut ne jamais être mise en évidence malgré un diagnostic certain de légionellose. La disparition des anticorps est plus variable (2 à 3 mois jusqu'à 12-18 mois).
Les inconvénients du sérodiagnostic :
- ne permet qu'un diagnostic tardif voire rétrospectif.
- de nombreuses réactions croisées en IFI ont été décrites : avec les mycobactéries, les leptospires, Chlamydia, Mycoplasma, Citrobacter, Campylobacter et Coxiella burnetii. Des réactions croisées sont également rencontrées entre les différents sérogroupes et entre les différentes espèces de Legionella.
Avantages :
Cette méthode permet le diagnostic de légionelloses dues à des espèces ou des sérogroupes de Legionella non diagnostiqués par une recherche d'antigène urinaire ou difficilement isolés par culture.
VII - Amplification génique
Les tests basés sur l’amplification génique sont utilisés pour détecter les légionelles dans les prélèvements d’urines, les lavages broncho-alvéolaires et les sérums. Cette méthode de diagnostic ne fait pas partie actuellement des critères de définition des cas de légionelloses. Les études réalisées semblent montrer que les techniques PCR utilisées pour le diagnostic des légionelloses présentent une forte spécificité mais une sensibilité modérée qui sera probablement améliorée par les techniques récentes de PCR en temps réel.
Les avantages principaux des techniques d’amplification sont la rapidité de la détection des Legionella et la possibilité de détecter les autres espèces de Legionella que L. pneumophila.
Evaluation des méthodes du diagnostic biologique des légionelloses
| Délai de réponse | Sensibilité % | Spécificité % |
Valeur prédictive positive % |
Valeur prédictive négative % |
|
| Culture | 3 à 10 jours | 62 | 100 | ||
| Immunofluorescence directe | < 4 h | 25 | 65 | ||
| Antigènes urinaires | < 1h | 56-80* | 99 | 86 | 95 |
| Augmentation du titre des anticorps | 3 à 10 semaines | 75 | 95-99 | ||
| Titre unique élevé précoce | 10 | 94 | 15 | 91 | |
| Titre unique élevé tardif | 65 | 94 | 54 | 96 |
Technique développée vis-à-vis de L. pneumophila sérogroupe 1 uniquement.
* 80 % si on ne considère que L. pneumophila sérogroupe 1.
LES ENQUETES EPIDEMIOLOGIQUES
La première phase de l'investigation des cas est une enquête épidémiologique clinique. Elle comprend un interrogatoire qui permettra de définir les dates et les lieux précis de séjour des cas, la date de survenue des symptômes, la compatibilité entre ces dates et la période d'incubation de la légionellose (2 à 10 jours) et de relever méticuleusement les activités des patients pendant les dix jours qui précèdent leur maladie. Cette investigation permet de définir s'il s'agit d'une légionellose communautaire (liée ou non à un voyage) ou nosocomiale, et de repérer les cas groupés.
| La seconde phase de l'investigation est l'enquête épidémiologique microbiologique. Des outils moléculaires permettent d’établir des liens de clonalité entre des souches isolées de malades et des souches isolées de l'environnement et ainsi confirmer la source de la contamination. L'analyse des profils de macrorestriction de l'ADN total par électrophorèse en champ pulsé ("pulsed-field gel electrophoresis" ou PFGE) est la technique la plus discriminante pour typer des souches de Legionella. Par cette technique, le chromosome est coupé par des enzymes à sites de clivages rares donnant de grands fragments (10 à 800 kb) qui nécessitent une technique d'électrophorèse en champ pulsé. La technique est longue (4 jours en moyenne). |
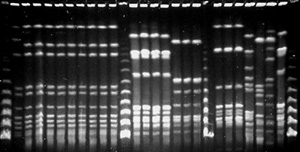 |
Cette méthode présente l’inconvénient majeur d’une faible reproductibilité inter-essai. Pour permettre un échange européen des données du typage moléculaire des souches de légionelles, une technique basée sur le séquençage nucléotidique (MLST, Multi Locus Sequence Typing ou typage de séquence multi-locus) est en développement (Maiden et Bygraves, 1998). Les avantages du MLST par rapport aux techniques usuelles de typage consistent en la précision et la reproductibilité des données du séquençage, et en l’accessibilité de celles-ci sur internet.
6 - Sensibilité aux antibiotiques et approche thérapeutique
I - Sensibilité aux antibiotiques
Les antibiotiques généralement considérés comme efficaces dans les légionelloses sont les macrolides, les fluoroquinolones, les tétracyclines et la rifampicine.
Trois méthodes peuvent être utilisées pour déterminer la sensibilité des légionelles aux antibiotiques :
- les tests extracellulaires,
- les tests intracellulaires,
- les études de traitement des cobayes infectés.
L'activité extracellulaire des antibiotiques vis-à-vis des légionelles peut être étudiée par des méthodes conventionnelles de détermination des CMI sur milieux gélosés ou par la méthode des bandelettes E-test..
Les légionelles étant des bactéries à développement intracellulaire, l’étude in vitro de la sensibilité aux antibiotiques de ces bactéries ne peut être directement corrélée avec l’activité clinique des molécules.
Une étude systématique de la sensibilité des souches de légionelles aux antibiotiques n’est donc pas recommandée du fait de résultats ininterprétables en clinique.
L'activité intracellulaire des antibiotiques peut être étudié après croissance de L. pneumophila sur divers modèles de cultures cellulaires comme les lignées cellulaires de monocyte-macrophage humains (lignée cellulaire HL-60).
L'activité des antibiotiques peut également être étudiée expérimentalement avec des cobayes par inhalation d'aérosols infectés ou par inoculation directe par voie intra-trachéale.
II - Approche thérapeutique
Aucune étude prospective, comparative de traitement, d’une puissance statistique suffisante n’a été réalisée compte tenu de la relative rareté des légionelloses.
Les macrolides
L’érythromycine a été longtemps considéré comme le traitement de référence des légionelloses depuis l’analyse rétrospective de l’épidémie initiale de Philadelphie en 1976. Elle est le plus souvent prescrite par voie intraveineuse, au début du traitement ou jusqu’à l’apparition d’une réponse clinique, à une posologie de 2 à 4 g/j selon la gravité de l’état clinique et pour une durée de 2 à 3 semaines. Une amélioration clinique avec diminution de la température est souvent observée rapidement dans les 12 à 48 heures après l’instauration du traitement alors que les infiltrats pulmonaires peuvent continuer à progresser.
On lui préfère de plus en plus les nouveaux macrolides, la clarithromycine et surtout l’azithromycine pour une activité in vitro similaire mais une meilleure pénétration intracellulaire, une activité intra-cellulaire bactéricide ainsi que des effets secondaires moindres. De plus, les propriétés pharmacocinétiques de l’azithromycine permettent des traitements plus courts de l’ordre de 5 jours.
La forme injectable de ces nouveaux macrolides n’est, cependant, pas encore disponible en France limitant leur utilisation aux légionelloses peu sévères.
Les fluoroquinolones (surtout la lévofloxacine) ont une activité in vitro et une activité intracellulaire meilleure que les macrolides.
Elles ont un intérêt chez les transplantés chez lesquels les macrolides et la rifampicine ne peuvent être utilisés en raison d’interaction avec les traitements immunosuppresseurs.
La rifampicine est connue pour avoir une forte activité in vitro et in vivo contre les légionelles et peut être associée à un macrolide ou à une fluoroquinolone à la dose de 20 à 30 mg/kg/j dans les formes sévères ou chez les immunodéprimés. La rifampicine est donnée dans les 3 à 5 premiers jours de traitement seulement, sauf dans les cas de sévère immunodépression ou de maladie extrapulmonaire sévère.
En pratique, les macrolides peuvent être utilisés en monothérapie pour les légionelloses communautaires non sévères. Les fluoroquinolones (notamment la lévofloxacine) et l’azithromycine sont devenues les antibiotiques de choix dans le traitement des légionelloses sévères et celles touchant les immunodéprimés.
Posologies recommandées dans le traitement des légionelloses (selon Stout et al. et Edelstein et al.)
| Azithromycine* | 500 mg / 24 h PO |
| Clarithromycine | 500 mg / 12 h PO |
| Roxithromycine | 300 mg / 12 h PO |
| Erythromycine | 1g / 6 h IV 500 mg / 6 h PO |
| Lévofloxacine* | 500 mg / 24 h PO ou IV |
| Ciprofloxacine | 400 mg / 8 h IV 750 mg / 12 h PO |
| Ofloxacine | 400 mg / 12 h PO ou IV |
| Doxycycline* | 100 mg / 12 h PO ou IV |
| Minocycline* | 100 mg / 12 h PO ou IV |
| Tétracycline | 500 mg / 6 h PO ou IV |
* un doublement de la posologie lors de la première administration est recommandé.
III - Prophylaxie http://www.invs.sante.fr
Les connaissances actuelles ne permettent pas de justifier la mise en place d’une antibioprophylaxie pour les personnes ayant été exposées à des aérosols contaminés. L’avis du CSHPF du 16 mars 1999 sur la place de l‘antibioprophylaxie dans la prévention des légionelloses nosocomiales est le suivant : “ L’antibioprophylaxie de la légionellose n’étant actuellement justifiée par aucun argument scientifique, elle ne saurait être mise en oeuvre à titre systématique devant la présence de légionelles dans l’eau. Cependant, en cas d’épidémie de légionellose nosocomiale, en sus des mesures de décontamination du réseau et de protection des patients contre l’exposition, une antibioprophylaxie par un macrolide peut se concevoir chez les sujets à risque. ”
IV - Prévention
La prévention de la légionellose repose sur une surveillance environnementale et clinique. Depuis la circulaire DGS n° 98/771 du 31 décembre 98 complétée et remplacée par la circulaire n° 2002/243 du 22 avril 2002 (http://www.sante.gouv.fr), il est nécessaire notamment pour les hôpitaux et les hôtels de mettre en place les mesures pour le contrôle et la prévention des légionelloses. Celles-ci nécessitent un programme d'entretien régulier des réseaux (nettoyage pour éliminer le tartre), une circulation permanente de l'eau avec élimination des bras morts et une température suffisante de l'eau (60°C au site de production et 50°C aux points d'usage). L’objectif cible dans les établissements de santé est de maintenir la concentration en légionelles inférieure à 103 UFC / litre d’eau. Pour les patients à haut risque (immunodéprimés sévères après transplantation, corticothérapie prolongée ou à haute dose), l’eau soutirée au niveau des points d’usage à risque doit comporter en permanence une concentration en L. pneumophila inférieure au seuil de détection.
Les propriétaires des tours aéro-réfrigérantes doivent également appliquer un protocole de nettoyage et d'entretien de ces tours.
L'éradication des légionelles dans l'eau reste difficile. Les bactéries peuvent également être tuées soit par choc thermique, soit par choc chloré ou par chloration continue.
La surveillance clinique est primordiale. Lors de la survenue d’un cas de légionellose d’origine nosocomiale probable, il est recommandé de mettre en place une surveillance clinique de tous les patients hospitalisés susceptibles d’avoir été exposé, afin de mettre en œuvre très rapidement le traitement approprié si cela s’avère nécessaire. La déclaration immédiate des cas communautaires permettra d’identifier le plus rapidement possible des cas liés ou groupés.
Ce cours a été préparé par :
Dr. Sophie Jarraud, Dr. Pascale Girardo, Dr. Monique Reyrolle, Pr. Jérôme Etienne.
Pour en savoir plus :

Quelques adresses:
Epidémiologie : http://www.invs.sante.fr
http://www.eurosurveillance.org/em/v07n09/0709-121.asp
Recommandations, circulaires : http://www.sante.gouv.fr/
http://dm3.univ-lyon1.fr/legio/LEGIONELLES0.htm
http://www.legionnellose.com/seminaire/seminaire%20ministere%20envir.shtml
|
|
|
|
|