- Préparation des frottis: Après avoir gravé au diamant sur la lame, le N° du ou des prélèvements, les frottis fins sont obtenus sur les 2/3 de la lame, laisser sécher le frottis à l'air ou sur une plaque chauffante à température moyenne. Puis fixer à l'alcool méthylique. La lecture microscopique des lames colorées se fait au grossissement final de 1000. Il faut examiner au moins 100 champs, environ 15 minutes avant de déclarer une lame négative.
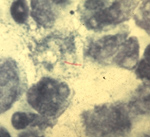
- Coloration 1: Plusieurs techniques sont utilisées pour colorer les mycobactéries présentes dans les prélèvements telles la coloration de Ziehl-Neelsen à chaud ou à froid Les Bacilles Acido-Alcoolo Résistants (B.A.A.R.) apparaissent rose sur fond bleu. La réponse doit toujours être faite en terme de présence ou absence de B.A.A.R
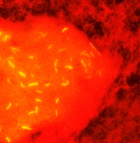
- Coloration 2: Autre méthode utilisant l'auramine (coloration de Degommier) et l'observation au microscope à fluorescence. Lire les lames au microscope à fluorescence, à l'objectif à sec 25 x pour un dépistage rapide, et à l'objectif 40 x pour confirmation. Il faut lire au moins 30 champs par lame avant de déclarer une lame négative. Les mycobactéries apparaissent jaune fluorescentes sur fond rouge.
Pour des cas particuliers, la coloration de Ziehl peut se faire par surcoloration d'une lame déja colorée à l'auramine.

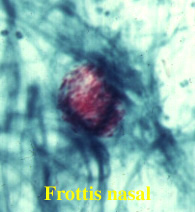
- Coloration 3: D'autres techniques ou modalités sont utilisées pour colorer les mycobactéries telle M. leprae présentes dans les prélèvements tel muqueuse nasale. La coloration de Ziehl-Neelsen modifiée permet la mise en évidence de "globies" caractéristiques dans le diagnostic de certaines phases de la lèpre.