CARBAPENEMASES DE CLASSE B
- Des ß-lactamases transférables appartenant à la classe B (métalloenzymes, donc sensibles à l'EDTA) ont été rapportées dès les années 90, initialement au Japon (IMP-1 pour IMiPénémase) chez Pseudomonas aeruginosa.
- D'autres ß-lactamases telles les enzymes VIM (pour Verona IMipénémase) ont été rapportées par la suite initialement en Europe et chez P. aeruginosa.
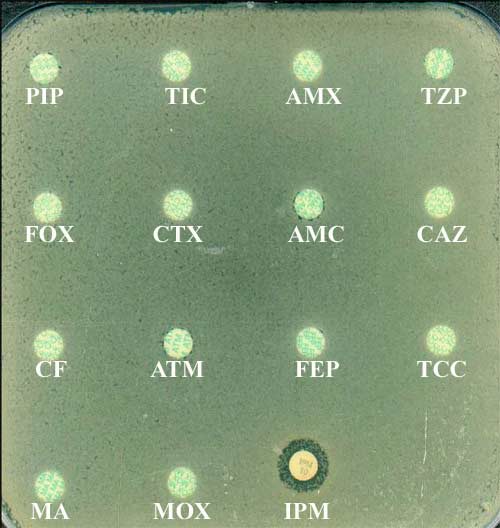
- Ces enzymes sont responsables de la résistance acquise à diverses ß-lactamines telles les pénicillines (ticarcilline, pipéracilline), céphalosporines (ceftazidime, céfépime) ou encore carbapénèmes (imipénème). Seul l'aztréonam échappe à l'inactivation enzymatique, d'où un antibiotype particulier, de détection aisée:
- Cette résistance acquise, en particulier à l'imipénème, est en relation avec un type d'enzyme particulier (métalloenzyme), donc sensible à certains chélateurs comme l'EDTA. Un test microbiologique rapide et simple permet une approche en routine comme illustrée ci-dessous:
- Le spectre d'inactivation de VIM-1 est plus facilement évalué après transfert chez une souche réceptrice de E. coli, sensible aux ß-lactamines:
- La détection de ce type peut se compliquer lors de production simultanée avec d'autres ß-lactamases telle une BLSE. En l'absence d'approche moléculaire plus analytique, il est possible de fortement suspectée une telle combinaison d'enzymes en jouant sur les inhibiteurs par classe d'enzyme (A, B, C) et leurs substrats préférentiels:
Klebsiella pneumoniae productrice de VIM-1 et SHV-5
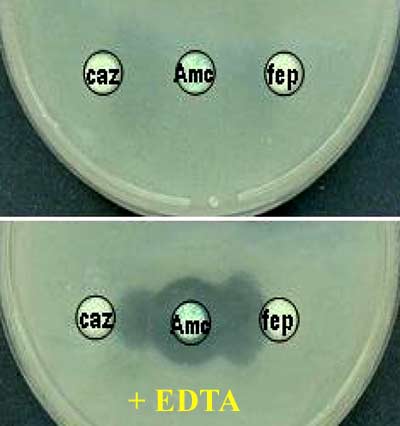
1/ Détection (classe B): inhibition de l'imipénèmase par l'EDTA


2/ Détection de la BLSE (classe A): dépôt d'EDTA sur un disque d'amoxicilline+ acide clavulanique (Amc) et recherche d'une synergie C3G/C4G (caz/fep).
- Seule l'approche moléculaire apportera la certitude scientifique pour ce type de souche isolée en clinique.
|
|
|
|
|





