ß-LACTAMASES: GENERALITES
1 - DEFINITION
Les ß-lactamases sont des enzymes d'inactivation de type sérine (classes A, C et D) ou métalloenzymes (classe B) dont les substrats sont des ß-lactamines, constituant la principale et la plus importante famille d'antibiotiques, pouvant être classée en sous-groupes selon la structure du noyau de base (péname, oxapéname, pénème, céphéme, oxacéphème, azétididone ......).
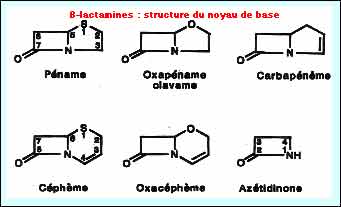
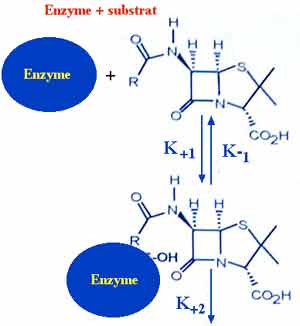
L'inactivation enzymatique (perte de l'activité antibiotique) survient lors de l'ouverture du cycle ß-lactame (structure de base des ß-lactamines retrouvée dans tous les sous-groupes). La première étape de la réaction enzymatique variera en fonction du substrat (affinité) tels pénicilline G, oxacilline, ampicilline, carbénicilline, pipéracilline, céfalotine, céfuroxime, céfotaxime, imipénème......
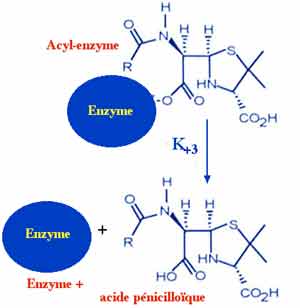
Cette étape de formation d'un complexe enzyme-substrat sera fonction des constantes cinétiques de l'enzyme étudiée telles affinité appréciée par le Km ou Ki, ou encore vitesse d'hydrolyse exprimée, le plus souvent, en Vmax.... Le produit de la réaction aboutit à la formation de composés acides tels acide pénicilloïque ou céphalosporoïque...
Profils d'inactivation par macrométhode acidimétrique (bleu de bromothymol pour indicateur de pH)

Chaque tube numéroté (1, 2, 3, 4.....) correspond à un substrat de type ß-lactamine, le tube T étant un témoin sans ß-lactamine (pas de virage).
2 - QUELQUES ETAPES DE LEUR HISTOIRE
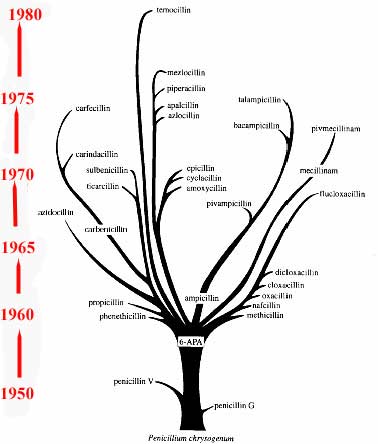
* En 1940, apparait la première publication sur la découverte d'une enzyme d'inactivation de type pénicillinase chez "Bacterium coli". Lors de la production artisanale de pénicilline G en boites de Roux, surtout en bidons de lait à l'Université d'Oxford dans la laboratoire dirigé par Florey H (Sir William Dunn School of Pathology), Chain E. avec Abraham E. P. remarquèrent des productions variables de pénicilline G (appréciée évidemment en Unités Oxford). Il convient de rappeler la part essentielle de cette équipe dans la production "artisanale" de pénicilline, couronnée par l'attribution d'un Prix Nobel de Médecine: http://nobelprize.org/medicine/laureates/1945/chain-bio.html.


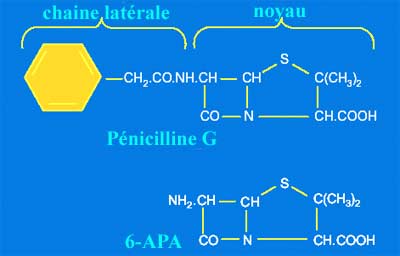 |
* La découverte ultérieure de l'obtention industrielle du noyau 6-APA (acide 6-aminopénicillanique) par une équipe britannique dont Batchelor R. et Rolinson G. ouvrit la voie à la découverte future de nombreux dérivés d' hémi- synthèse et l'introduction ultérieure en clinique de nouvelles ß-lactamines. |
**L'intérêt de ces enzymes se réfère maintenant à diverses étapes médicales, d'où leur découverte à la suite d'échecs de traitement pour cause de résistance acquise. Néanmoins, dans les années 60, la notion de ß-lactamines à spectre large comme celui des amino-pénicillines vis-à-vis de certaines espèces d'entérobactéries, outre Escherichia coli, Proteus mirabilis..... allait aussi permettre de préciser la notion de résistance naturelle par production de ß-lactamases chez des entérobactéries telles Klebsiella pneumoniae, Enterobacter cloacae..... Puis avec l'introduction de nouvelles molécules de plus en plus efficaces ou actives, sera décrite l'émergence de nouveaux types d'enymes entre 1980 et 2000 : BLSE, TRI/IRT, céphalosporinases plasmidiques, carbapénèmases....
*** Le rôle du bactériologiste médical a été essentiel dans leur identification. En effet, l'introduction continuelle de nouvelles molécules entre 1955 et 1995 en clinique a généré de nouveaux phénotypes de résistance, donc l'identification ultérieure d'enzymes. L'individualisation de phénotypes de résistance qu'il soit naturel ou résistant nécessite un choix judicieux des ß-lactamines à tester, en particulier par la méthode de diffusion incluant l'éventuelle détection de synergie, voire d'antagonisme, ce qui inclut de bonnes connaissances des propiétés enzymatiques.
3 - DETECTION RAPIDE DE ß-LACTAMASES
- Bien qu'au moins 350 enzymes aient été identifiées, leur nombre réel est certainement très supérieur d'autant que l'apport de la génomique permet d'identifier dans la plupart des génomes publiés des ß-lactamases hypothétiques ou probables ("putative") permettant une identification moléculaire et des clonages plus faciles et rapides.
- Cependant il y existe, au moins historiquement, une approche plus classique de leur éventuelle présence par diverses méthodes dont celles bactériologiques.
3-1 Première approche bactériologique (antibiogramme): L'éventuelle présence d'une ß-lactamase, voire de deux pouvait être évoquée à la lecture attentive d'un antibiogramme par diffusion avec un choix judicieux de ß-lactamines. Quatre exemples relativement récents et simples illustrent l'importance de bien utiliser ce type de méthode, peu onéreuse et riche de découvertes.
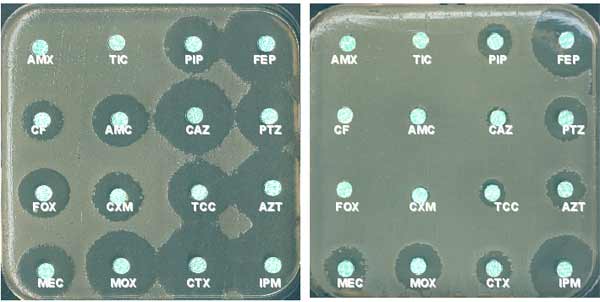
3-1-1 Voici en 1978, un antibiogramme de Klebsiella pneumoniae sauvage caractéristique du phénotype "pénicillinase de bas niveau" identifié avec les ß-lactamines suivantes: AMX, amoxicilline; TIC, ticarcilline ou la carbénicilline; AMX, amoxicilline + acide clavulanique; CF, céfalotine.
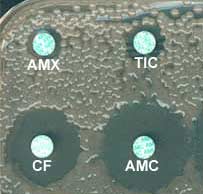
Cette période d'individualisation de phénotypes de résistance naturelle au sein des entérobactéries allait amener à la lecture interprétative de l'antibiogramme.
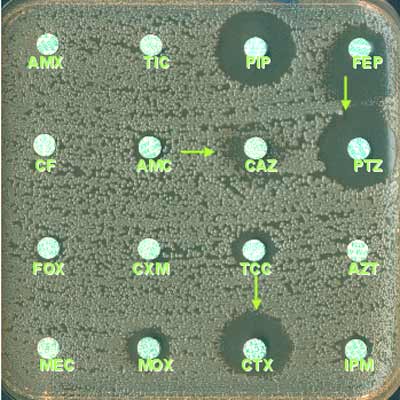
3-1-2 Voici en 1986, un transfert de la résistance aux C3G à partir d'une souche clinique de Klebsiella pneumoniae de sensibilité diminuée au céfotaxime (CMI de 1 mg/L) chez une souche réceptrice (Escherichia coli), donc sensible aux céphalosporines de troisième génération (C3G)(à gauche, diamètres observés > 30 mm et absence totale de synergie). Un des transconjugants sélectionnés sur le milieu supplémenté avec 5 mg/L de céfotaxime (CTX) a été contrôlé par la méthode de diffusion avec les ß-lactamines suivantes (à droite): ATM, aztréonam; CTX, céfotaxime; CRO, ceftriaxone; CAZ, ceftazidime; AMC, amoxicilline + acide clavulanique. Pour les autres ß-lactamines non montrées (AMX, TIC, CF), la souche était de phénotype "pénicillinase de très haut niveau".
E. coli, souche réceptrice avec plasmide codant pour le type TEM-3
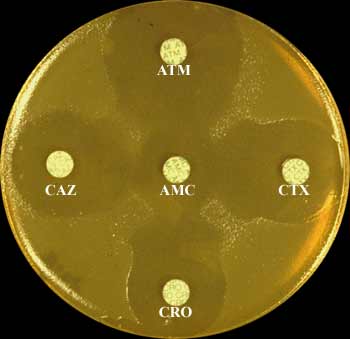
E. coli, souche réceptrice sans plasmide

3-1-3 Voici en 1996, un antibiogramme obtenu à partir d'une souche clinique de Klebsiella pneumoniae de phénotype "céphalosporinase inductible" (bien regarder entre ATM et IPM), donc a priori il s'agissait d'un phénotype impossible détecté, en particulier par la résistance aux C3G dont la ceftazidime (CAZ) en l'absence de synergie avec l'association de l'amoxicilline + acide clavulanique (AMC).
Une telle éventualité, impossible jusqu'alors, exigeait d'abord de confirmer l'identification bactérienne (phénotype impossible ou inconnu), puis d'identifier ce nouveau mécanisme de résistance. Dans cet cet exemple, il s'agissait d'une souche de K. pneumoniae productrice d'une céphalosporinase plasmidique inductible (DHA-1). Le caractère d'inductibilité probable a été détecté par un léger antagonisme entre l'aztréonam (AZT) et l'imipénème (IPM).
- Le caractère inductible d 'une ß-lactamase est facilement identifié par ce type de méthode (diffusion). Il conviendra de rechercher une diminution de l'activité antibactérienne avec certaines ß-lactamines inductrices (imipénème/IPM ou céfoxitine/FOX, par exemple) pour certaines espèces bactériennes naturellement résistantes telles Enterobacter cloacae (à gauche) ou Hafnia alvei (à droite)


3-1-4 Voici en 1997, un antibiogramme d'une entérobactérie d'isolement très rare (Kluyvera ascorbata) montrant un phénotype de résistance inhabituel "pénicillinase de bas niveau mais avec une inactivation probable et significative de la céphalotine, CF" en raison de la synergie observée entre CF et AMC. Ce phénotype est nettement à distinguer de celui "pénicillinase de bas niveau". Un antibiogramme complémentaire comprenant, par exemple le céfuroxime (CXM) stable vis-à-vis des pénicillinases plasmidiques TEM est effectué. La synergie identifiée entre le CXM et l'AMX oriente vers une enzyme "chromosomique (bas niveau) à très large spectre". Après clonage du gène correspondant (KLUA-1) dans une souche réceptrice de E. coli , a été identifié, par la suite, un des progéniteurs de BLSE plasmidiques de type CTX-M. De plus, la notion de gènes chromosomiques codant pour une BLSE chez les entérobactéries a justifié la création d'un nouveau groupe phénotypique (5) chez les entérobactéries (cf phénotypes de résistance naturelle chez les entérobactéries).
- En conclusion, la méthode microbiologique avec la lecture attentive d'un antibiogramme par diffusion ainsi qu'un choix judicieux de ß-lactamines couplée à une bonne disposition des disques de ß-lactamines et une bonne connaissance des nombreux phénotypes de résistance naturelle et acquise peut permettre de détecter rapidement au laboratoire un nouveau phénotype de résistance aux ß-lactamines en relation avec la production probable d'une ou plusieurs "nouvelles" ß-lactamases.
3-2 Deuxième approche bactériologique (test de Gots):
L'antibiogramme ci-dessous montre une souche de S. aureus (à droite) "apparemment sensible" à la pénicilline G (P) avec un diamètre d'inhibition comparable à celui d'une souche sensible ß-lactamase - (à gauche).
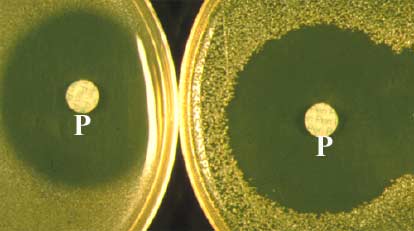
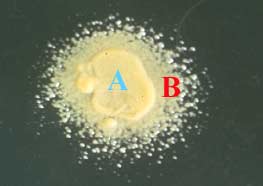
L'éventuelle production d'une enzyme d'inactivation (ß-lactamase) peut être recherchée en ensemencant la souche de droite (A) à la surface d'une gélose nutritive. Mais celle-ci a été au préalable supplémentée (en surfusion à 42°C) d'une part, avec une ß-lactamine, pénicilline G par exemple, et d'autre part avec une souche bactérienne sensible à cet antibiotique; Micrococcus spp. par exemple. Après ensemencement de la souche à tester (A) à la surface de cette gélose, celle-ci est incubée, par exemple à 37°C ou 30°C pendant 24 ou 48 h.
La production d'une ß-lactamase par la souche A entraine la destruction de la péniclline G incorporée dans le milieu gélosé ce qui a, pour effet, de permettre la culture de la souche révélatrice sensible (B) inhibée jusqu'alors. Ce test est très sensible, simple, peu onéreux et souple. Car il est possible de supplémenter la gélose avec n'importe quelle ß-lactamine.
3-2 Approches non bactériologiques :
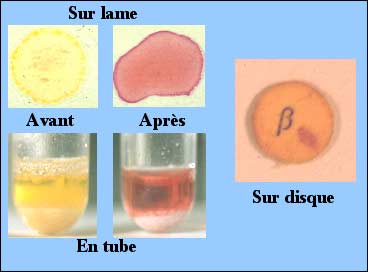
3-2-1 L'éventuelle présence d'une ß-lactamase peut être rapidement recherchée en préparant un extrait brut de la souche à examiner puis à le tester par le virage plus ou moins rapide d'une ß-lactamine chromogénique de type céfinase comme montré ci-dessous sur lame, en tube ou plus communément, à l'aide d'un disque de papier imprégné de nitrocéfine (en bas). Cette méthode sera surtout utile pour des espèces naturellement non productrices de ß-lactamase. Elle est d'ailleurs très utilisée en pratique médicale lors de l'isolement de souches de Haemophilus influenzae, par exemple.
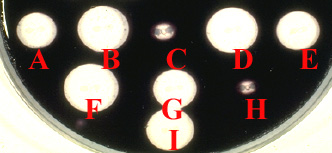
3-2-2 Une autre méthode simple et peu onéreuse (Méthode de Perret, 1955) mais considérée comme ancienne peut être très utile selon plusieurs modalités techniques précisées ci-dessous.
| La méthode iodométrique qui consiste à préparer une gélose avec de la pénicilline G, de l'amidon et une solution d'iode. La coloration initiale de la gélose (iode + amidon) est violette ou bleu foncée. Après avoir préparé un extrait brut à partir d'une culture bactérienne (milieu liquide ou solide), celui-ci est testé après avoir déposé soit en surface (1 goutte), soit 5-10 µl dans un puits (créé avec un emporte-pièce) puis à observer la décoloration en fonction du temps (à droite). |
 |

Cette méthode simple et peu onéreuse peut être utilisée pour révêler des ß-lactamases à partir d'un extrait brut analysé après séparation électrophorétique sur un gel de polycrylamide (voir à pI).
4 - CARACTERES D'IDENTIFICATION ENZYMATIQUE
4 -1 Parmi les premiers critères testés, la localisation de la ß-lactamase a été recherchée. Il s'agira d'une localisation exocellulaire (mesure positive d'une activité enzymatique dans le surnageant de culture d'une bactérie à Gram-positif. En revanche, pour une bactérie à Gram-négatif, la localisation est endocellulaire ou périplasmique, ainsi l'activité enzymatique sera liée aux corps bactériens (grattage de colonies possible). L'intérêt actuel de ce critère reste très limité.
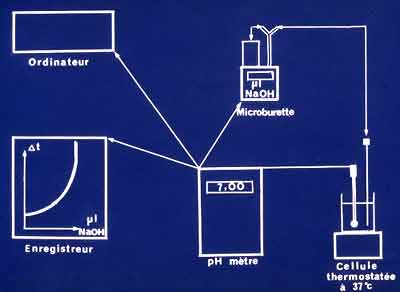
4 -2 Les critères cinétiques permettent, en revanche, de préciser le spectre d'inactivation de la ß-lactamase et l'on pourra comme pour toute enzyme, rechercher diverses constantes telles Km (constante de Michaelis-Menten, µM), kcat (µM), Ki (µM) ou encore la vitesse d'hydrolyse, en particulier en excès de subtrat (Vmax). Plusieurs méthodes ont été proposées telle la méthode acidimétrique à pH constant ou encore celle spectrophotométrique (plus utilisée et recommandée). La première méthode va mesurer à pH constant (pH mètre), la consommation de NaOH en µl en fonction du temps qui sera liée à la quantité d'acide pénicilloïque ou céphalosporoïque formé.
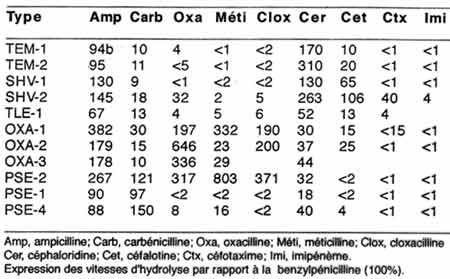
4 -2-1 - Le spectre d'inactivation ou profil de substrats d'une ß-lactamase peut être très différent selon le type enzymatique et permettra de caractériser une enzyme par les termes suivants: pénicillinase, céphalosporinase, oxacillinase, céfuroximase, ceftazidimase, céfotaximase, carbapénémase, imipénémase.......... L'expression la plus habituelle est celle de Vmax relative par rapport à un substrat (100%) de pénicilline (acidimétrie) ou céphalosporine (spetrophotométrique).
Exemples de profils d'inactivation (Vmax relative, pénicilline G = 100%)(1972)
. 
Voici un exemple récent d'une identification enzymatique chez une souche de Bordetella bronchiseptica (BOR-1)(Lartigue MF. et al, AAC. 2005).
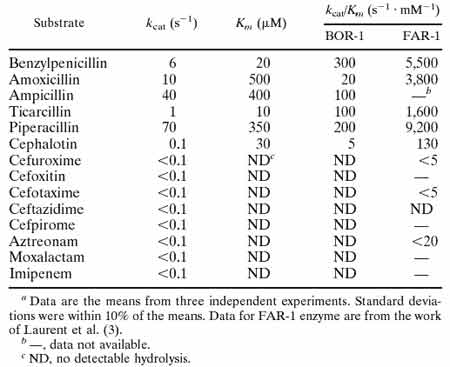
- La purification de la ß-lactamase pourra être plus ou moins poussée jusqu'au stade de cristaux. Elle sera d'autant plus nécessaire que la souche bactérienne produira plusieurs ß-lactamases ou que des études enzymologiques plus poussées seront nécessaires afin de déterminer, par exemple, la structure tertiaire par diffraction de rayons X. Beaucoup de questions restent poussées relatives au réel fonctionnement de ces enzymes.
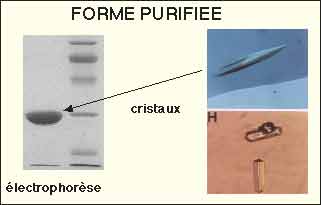
Bouthors AT et al., Biochem J. 1998 (purification de PER-1)
Exemple d'un modèle de structure tridimensionnelle

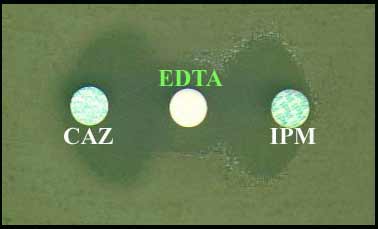
4 -2-2 - Le profil d'inhibition d'une ß-lactamase a une valeur historique importante, car divers d'inhibiteurs ont été testés afin de pouvoir caractériser les premières enzymes découvertes: chimiques tels EDTA, pCMB, Cl-..........., immunologiques (anticorps) ou encore de type ß-lactamine (inhibiteur compétitif).
Exemples de quelques profils d'inhibition (années 75-80)
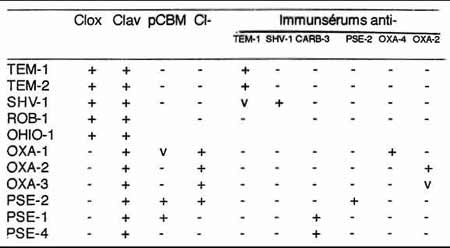
clox, cloxacilline; clav, acide clavulanique; pCMB, para-chloromercuribenzoate; Cl-, ions chlorures.
- L'intérêt historique des inhibiteurs enzymatiques est d'avoir permis de développer le concept d'inhibiteur en clinique en rendant une souche bactérienne, initialement résistante, sensible à une pénicilline en présence d'un inhibiteur compétitif. Ce concept développé dans les années 75 a montré l'intérêt expérimental de l'association amoxicilline + cloxacilline (inhibiteur très puissant de ß-lactamases de type céphalosporinase) vis-à-vis d'une souche de Pseudomonas aeruginosa de phénotype sensible. La recherche ultérieure et systématique a permis aux Laboratoires Beecham de découvrir l'acide clavulanique dans des cultures contaminées par du Streptomyces clavuligerus.
Intérêt de quelques inhibiteurs pour l'identification d'une ß-lactamase
|
Inhibiteurs
|
ß-lactamase
|
Utilisation en pratique bactériologique
|
| Acide clavulanique | Classe A | Résistance aux C3G par BLSE |
| EDTA | Classe B | Résistance à l'imipénème ou à la ceftazidime |
| Cloxacilline | Classe C | Résistance aux C3G par production simultanée d'une céphalosporinase et d'une BLSE |
| Ions Cl- | Classe D | Inactivation d'un extrait brut en sérum physiologique (oxacillinase) |
- L'intérêt actuel des inhibiteurs est, donc, multiple. D'abord ils peuvent permettre la caractérisation rapide de ß-lactamases de type BLSE (classe A) ou celles de la classe C (céphalosporinases) très sensibles à certaines pénicillines (oxacilline, cloxacilline, carbénicilline.....). Ainsi cette propriété d'inhibition spécifique est utilisée pour investiger une souche de K. pneumoniae productrice de plusieurs enzymes telle une céphalosporina- se plasmidique et une BLSE (ß-lactamase à spectre élargi/étendu). La mise en évidence de la BLSE sera difficile vis-à-vis de la ceftazidime ou du céfotaxime, car l'action de la céphalosporinase plasmidique (non inhibée par l'acide clavulanique) sera prépondérante. Aussi afin d'individualiser la BLSE, il conviendra d'effecter un antibiogrammme par diffusion avec une gélose de Mueller-Hinton supplémentée en cloxacilline puis de rechercher une synergie avec un disque d'Augmentin® et de ceftazidime.......
Exemple de VEB-1 chez Acinetobacter baumannii ?: http://www.invs.sante.fr/presse/2003/le_point_sur/inf_a_baumannii_311203/, cliquer pour avoir le document en pdf à lé référence 4.
- L'exemple ci-dessous, à savoir une souche de E. coli, hyperproductrice de sa céphalosporinase chromosomique a été examinée d'une part vis-à-vis d'un milieu de Mueller-Hinton normal (à droite) et d'autre part vis-à-vis d'un milieu de Mueller-Hinton supplémentée en cloxacilline (300 mg/L) (à gauche). Après inhibition de la céphalosporinase, le phénotype "pénicillinase" est clairement individualisé.
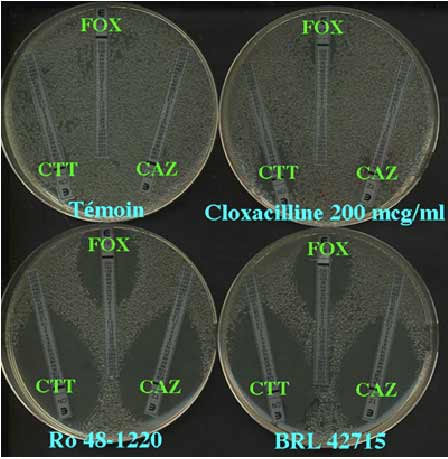
- Parmi les autres inhibiteurs enzymatiques dont certains ne sont pas commercialisés, certaines combinaisons ont été proposées pour la détection simple des céphalosporinases plasmidiques. La connaissance exacte des propriétés cinétiques des ß-lactamases peut permettre de proposer un test de synergie adapté en fonction des émergences de résistance. Ainsi dans les années 90-95, ce type d'enzyme est devenu préoccupant d'autant que son éventuelle association avec la production d'une BLSE rendait difficile la détection. Compte tenu des spectres d'inactivation différent entre BLSE et CASE plasmidique, il pouvait être judicieux de tester un excellent inhibiteur d'enzymes des classes A et C vis-à-vis des C3G mais aussi de céphamycines (céfoxitine/FOX, céfotétan/CTT) comme montré ci-dessous:
Détection d'une céphalosporinase plasmidique (CMY-2) chez un transconjugant (E. coli)(en rouge: le BRL 42715)

Détection comparative de CMY-2) chez E. coli
- Voici un autre exemple récent d'une souche de P. aeruginosa multirésistante aux ß-lactamines dont l'imipénème (IPM) à l'exception de l'aztréonam (ATM) isolée chez un malade en provenance d'un pays étranger. Le phénotype évocateur de la production, très rare actuellement dans notre pays, d'une carbapénémase de type IMP ou VIM (classe B) a nécessité de rechercher rapidement, l'éventuelle synergie avec une solution d'EDTA (chélateur d'ions Zn++ nécessaires à l'activité enzymatique des ß-lactamases de type B).
P. aeruginosa: détection d'une carbapénémase de la classe B (VIM-2) par la méthode de diffusion (pour les antibiotiques en jaune, apport de 20 µl d'une solution de EDTA)(Guérin F. et al., JAC, 2005)
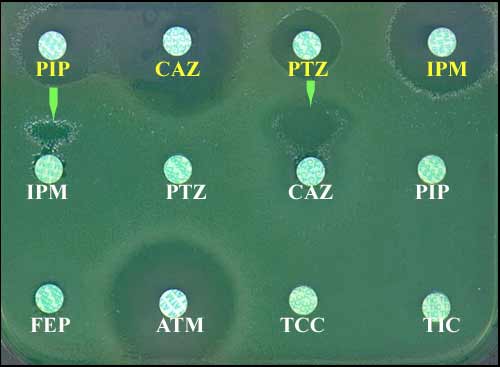
P. aeruginosa (suite)
Guérin F. et al., JAC, 2005
Pour en savoir plus: http://www.bioscience.org/1999/v4/e/bonomo/fulltext.htm
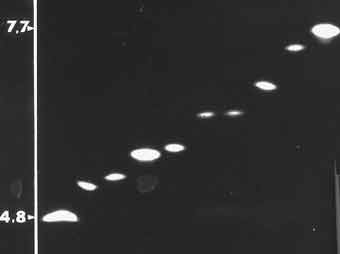
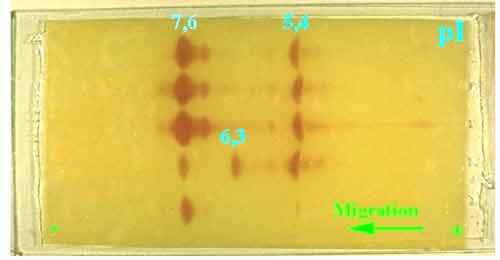
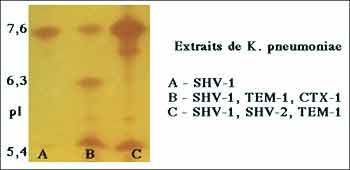
4 -3 - Parmi les autres paramètres biochimiques utiles à l'identification, la détermination de la masse moléculaire (25.000 - 35.000) n'a qu'un intérêt limité, de même que celui du point isoélectrique (pI). Ce dernier critère a été très utilisé, dans les années 70, en raison de sa faible variation pour les pénicillinases plasmidiques connues à l'époque (TEM-1, 5,4; TEM-2, 5,6, PIT-2/SHV-1 7,6-7,7...............). En revanche pour des raisons épidémiologiques ou lors de l'isolement d'un phénotype inhabituel, il était possible de rechercher rapidement à identifier le contenu "ß-lactamases" d'une ou plusieurs souches cliniques d'entérobactéries, par exemple. L'apport plus récent de l'identification génomique a limité l'impact de ces deux paramètres d'autant qu'ils peuvent être calculer indirectement dès l'obtention de la séquence peptidique.
Exemple de variations de pI de diverses ß-lactamases (MAL-1, TEM-1, TEM-2, CTX-1, SHV-1......) révélées sur un gel de polyacrylamide par la méthode iodométrique
Exemple de contenus "ß-lactamase" de souches cliniques de K. pneumoniae révélès sur un gel de polyacrylamide par la méthode chromogénique (nitrocéfine)
- 4-4 Identification génomique
La détermination de la séquence nucléotidique, puis peptidique est devenue l'étape indispensable de l'identification d'une nouvelle ß-lactamase ou pour des études épidémiologiques avec l'amplification génique (PCR). Il est vrai que l'automation a apporté souplesse, rapidité et diminution des coûts. De plus, il est devenu possible de séquencer beaucoup plus haut en amont et en aval amenant une meilleure connaissance de leur organisation génétique (cf cours "ß-lactamases: aspects génétiques".
Exemple d'une PCR mutiplex
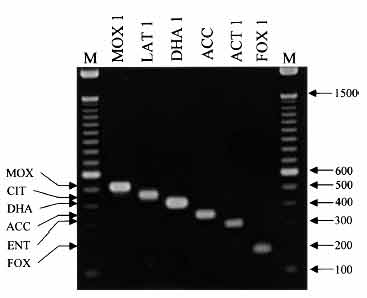
http://jcm.asm.org/cgi/content/full/40/6/2153?view=long&pmid=12037080
- Seul le séquencage du gène bla permet une identification réelle, car une seule substitution en acide aminé peut entrainer une modification importante du spectre enzymatique, les meilleurs exemples restant encore les BLSE dérivées de TEM, SHV ou encore les OXA: http://www.lahey.org/Studies/
Les comparaisons de séquences peptidiques ont montré l'existence de motifs ou éléments (séquences courtes en acides aminé) souvents conservés ou partiellement dégénérés, propres à chaque classe de ß-lactamases (A, B, C, D)(cf classification):
Motifs des ß-lactamases de type sérine (S) enzyme
|
ß-lactamase
|
1
|
2
|
3
|
|
A
|
SxxK
|
SDN
|
(K/R)(S/T)G
|
|
C
|
STFK
|
YAN
|
KTG
|
|
D
|
STFK
|
SxV
|
K(T/S)G
|
Ces motifs sont présents dans le site actif et interviennent, donc, dans l'activité catalytique de manière directe ou indirecte.
Alignement de séquences avec les motifs de ß-lactamases de la classe C

5 - NOMENCLATURE
- L'absence, préjudiciable, de règles de dénomination précises, à l'exception de la création initiale des termes "pénicillinase" et de "céphalosporinase" entraine une continuelle confusion avec au fur et à mesure du temps, des substitutions de dénominations. Ainsi une pénicillinase plasmidique PIT-2 dans les années 70 a été redénommée SHV-1 pour "Sulfi Hydroxyl Variable". Un autre exemple ancien d'attribution de plusieurs dénominations pour désigner la même enzyme de type BLSE illustre ce propos: TEM 101, TEM-10, CAZ-3, YOU-2 et CAZ-lo. En fait, toutes ces enzymes sont identiques.
- En l'absence de règles strictes de nomenclature, le nom attribué à telle ou telle ß-lactamase est le plus souvent à trois lettres majuscules (TEM) donc la raison de ce choix reste extrêmement variable :
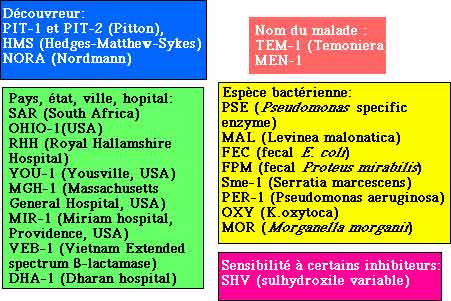
- Parmi les autres dénominations, il convient de citer la caractéristique enzymatique comme l'hydrolyse préférentielle d'une ß-lactamine, caractéristique d'un sous-groupe: CAZ pour ceftazidimase, CTX pour céfotaximase, IMP pour imipénémase..... ou alors une modification du profil d'inhibition tel TRI pour TEM Resistant aux Inhibiteurs, devenu ensuite IRT (Inhibitor resistant TEM).
- Compte tenu de la complexité grandissante de ce groupe enzymatique, il convient de choisir une dénomination qui évitera la confusion. Une enzyme de type BLSE mexicaine (TLA-1 pour TLAhuicas, tribu Inca d'avant l'invasion hispanique) parait avoir un parent (TLA-2) découvert en 2005 n'ayant que fort peu de parenté (aller sur http://www.ncbi.nlm.nih.gov/ et taper : beta-lactamase TLA-2).
6 - CLASSIFICATION
Compte tenu de l'extrême diversité de ce groupe enzymatique, les besoins d'une classification sont anciens. La première classification basée sur des critères scientifiques a été proposée dans les années 75 par Ambler. Elle prend en compte, les analogies de séquence peptidique, en particulier celles du site enzymatique, Ainsi 4 classes (A, B, C, et D) ont été identifiées (A, C, D = sérine enzymes et B = zinc types).
- La classification fonctionnelle de Bush, Jacoby, Medeiros de 1988 réflète mieux le spectre exact des enzymes, prenant en compte le profil de substrat (pénicilline, oxacilline, carbénicilline, céphaloridine, C3G, imipénème), ainsi que le profil d'inhibition. Ainsi apparait la notion de groupe fonctionnel tel le groupe 2b qui se subdivise en sous-groupes 2ba, 2bc...... Mais ce type d 'enzyme a un potentiel évolutif et une seule mutation (ponctuelle) peut changer le profil d'inactivation et celui d'inhibition: groupe 2b se subdivise alors en 2be. Néanmoins, elle est peu utilisée en pratique médicale.
Pour en savoir plus: http://www.srga.org/RAFMETOD/betamas2.htm
http://aac.asm.org/cgi/reprint/39/6/1211?view=reprint&pmid=7574506
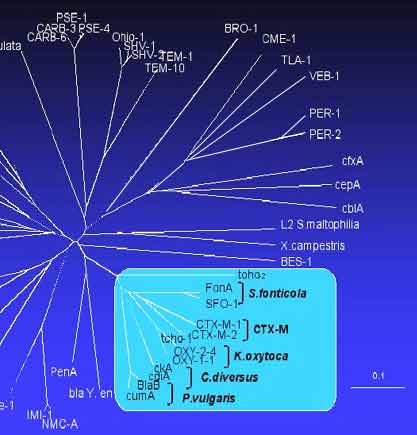
- L'accumulation des données génomiques sur ces enzymes dont le nombre actuel est de l'ordre de 350 rend incomplet, les essais de classification actuelle, surtout à visée médicale. Cependant les premiers résultats de classification en quatre classes (A, B, C, D) ne sont pas contredits par l'individualisation de petites séquences (motifs) propres à chacune d'entre elles:
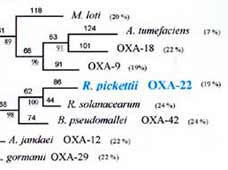
Un exemple : Comparaison de la séquence protéique d' OXA-60 (Ralstonia pickettii)

avec celle des oxacillinases OXA-50 de P. aeruginosa (Girlich et al., 2004), OXA-27, OXA-40 et OXA-58 de A. baumannii (Afzal-Shah et al., 2001; Héritier et al., 2003; Héritier et al., 2004), OXA-5 et OXA-10 de P. aeruginosa, OXA-48 de K. pneumoniae (Poirel et al., 2004), OXA-54 de S. oneidensis (Poirel et al., 2004), OXA-55 de S. algae (Héritier et al, 2004) et b115360 B. japonicum (Kaneko et al., 2002). La numérotation correspond à celle proposée pour les ß-lactamases de classe D (DBL)(Couture et al., 1992). Les acides aminés encadrés en rouge sont les résidus conservés des oxacillinases (Girlich D. et al. AAC. 2004).
Dendrogramme de plus de 120 ß-lactamases
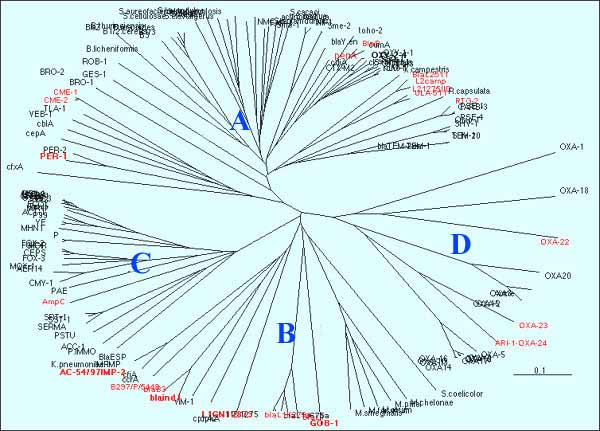
Il est évident que l'avenir proposera d'autres classifications, prenant en compte les nombreuses ß-lactamases découvertes au cours de ces dernières années.
7- ROLE - INCIDENCE
- Le rôle des ß-lactamases dans la résistance clinique reste toujours prépondérant, en particulier chez les bactéries à Gram-négatif malgré l'existence d' autres mécanismes de résistance aux ß-lactamines: modification d'affinité d'une ou plusieurs cibles (PLP ou protéines de liaison), imperméabilité, ou encore efflux.
La notion de ß-lactamines à spectre étroit découle de l'existence de la résistance naturelle par production de diverses ß-lactamases chromosomiques (cf phénotypes de résistance). Néanmoins, la commercialisation de "nouvelles molécules" à très large spectre comme les carbapénèmes montra l'existence, dans l'environnement, d'espèces naturellement résistantes. Ainsi on aura à l'esprit, la production naturelle de plusieurs ß-lactamases chez Chryseobacterium meningosepticum (BLSE de type CME, carbapénémases de type BlaB et GOB)(Bellais S. et al. FEMS Microbiol. Lett. 1999; Bellais S. et al. AAC. 2000; Rossolini G. et al. AAC 1999; Woodford G. et al. AAC 2000).
- La notion de résistance acquise découle, en particulier chez les bacilles à Gram-négatif tels entérobactéries, P. aeruginosa, Acinetobacter spp., de la production de diverses enzymes dont le détermisme génétique est très varié (cf déterminisme génétique).
- Le rôle éventuel et actuel de l'association de plusieurs mécanismes est devenu important à considérer comme celui de la résistance acquise à l'imipénème chez quelques souches d' E. cloacae , K. pneumoniae ou encore de Salmonella enterica par l'association d'une céphalosporinase transférable ou non et d'une imperméabilité (porine déficiente).
- Il conviendra devant cette accumulation de mécanismes de résistance, de pouvoir préciser les prévalences de résistance par certaines espèces et par pays. L'absence de nouvelles molécules oblige à cette quête épidémiologique, des mesures devront être prises afin d' éviter aussi une moindre diffusibilité de ces souches (cas des BMR) et enfin éduquer pour un emploi raisonné d'un, voire de plusieurs antibiotiques de type ß-lactamine aussi bien en médecine qu'en agriculture, harboriculture, aquaculture.........
Pour en savoir plus: ONERBA : http://www.onerba.org/bin/res/

EARSS : http://www.earss.rivm.nl/PAGINA/interwebsite/home_earss.html
Quelques exemples majeurs de résistance enzymatique (naturelle ou acquise) sont précisés ci-dessous par rapport à l'introduction de "nouveaux "antibiotiques entre 1944 et 2000:
1944: S. aureus et pénicillinase (Pénicilline G)
1955: résistance naturelle de bacilles à Gram-négatif (céphalosporinase/case inductible)(C1G)
1965: entérobactéries et ß-lactamases (bla) plasmidiques (TEM)(Ampicilline)
1980: hyperproduction de case chez certaines espèces d'entérobactéries (C3G)
1983: émergence des BLSE dérivées de TEM/SHV chez entérobactéries (C3G)
1988: céphamycinases (CMY) = cases plasmidiques, carbapénèmases (IMP-1)
1990: ß-lactamases TRI/IRT (Augmentin®)
1995: nouvelles BLSE (CTX-M, GES, VEB.....), autres cases plasmidiques(C3G au plan mondial)
2000: cases à spectre élargi (céfépime, cefpirome).
7 - CONCLUSION
La résistance naturelle aux ß-lactamines a toujours existé, sous-tendant la production de diverses ß-lactamases chromosomiques, mais la résistance acquise à ces antibiotiques sera une fatalité, imprévisible, de préférence, dans une espèce bactérienne et dans un ou plusieurs pays. Malheureusement la globalisation ou la mondialisation de la résistance bactérienne est bien une réalité, l'exemple des ß-lactamases illustre cette notion avec des cas d'importation de "nouvelles ß-lactamases" comme KPC-2 à Paris (Naas T, Nordmann P, Vedel G, Poyart C. AAC, 2005). Aussi, il convient de mieux connaitre par espèce bactérienne, les prévalences de résistance par pays mais aussi de forger les outils simples afin de détecter l'émergence de nouvelles enzymes.
La résistance acquise aux ß-lactamines est, en 2005, chez les bactéries multirésistantes, souvent en relation avec une ou plusieurs ß-lactamases, principal mécanisme d'adaptation des bactéries au traitement. Leur diversité est étonnante ainsi que leur potentiel d'évolution (moléculaire). Aussi leur détection rapide au laboratoire sera de plus en plus complexe, ainsi que l'interprétation à donner. Enfin on n'oubliera pas leur intérêt taxonomique lors de la validation (phénotypes de résistance particuliers). Ce type de connaissances exige une spécialisation, aussi la solution est de développer des sytèmes experts de l'antibiogramme.
Exemples de l'intérêt taxonomique de l'antibiogramme
Alcaligenes faecalis (à gauche) et Ralstonia pickettii (à droite)
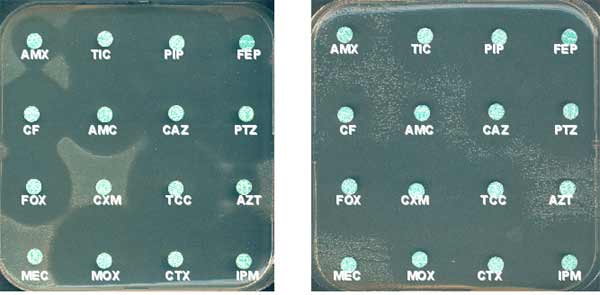
Au sein des bacilles à Gram-négatif non fermentaires, les deux espèces ci-dessus montrent un phénotype de résistance naturelle bien individualisé de type "pénicillinase" mais une absence de synergie pour celui de R. pickettii (comparer AMX et AMC et TIC et TCC). Les OXA sont, en effet, peu sensibles aux inhibiteurs de type acide clavulanique (Girlich D. et al., AAC. 2004).
Autres adresses:
http://www.chu-rouen.fr/ssf/prod/betalactamase.html
http://www.chups.jussieu.fr/polys/bacterio/resistlacta/POLY.Chp.8.html
http://www.pasteur.fr/recherche/genopole/PF8/betalact_en.html
http://www.bioinfo.de/isb/1998/01/0008/
http://www.rpc.msoe.edu/sepa/beta_lac.html
http://www.carb.nist.gov/osnat/lactamase.jpg
http://www.bichat.inserm.fr/equipes/Emi0339/E0339-GB.bis.html
http://www.lahey.org/Studies/
http://homepage.mac.com/barryghall/Ambler.html
Ce cours a été préparé par le Professeur A. Philippon (Université Paris V - Faculté de Médecine Descartes, Service de Bactériologie - 75014 PARIS)(Nouvelle Version du 10.12.05).
|
|
|
|
|