Introduction
Après plus de vingt ans de diffusion du VIH dans le monde, la pandémie de VIH/SIDA n’est pas à son apogée loin de là et les estimations d’un doublement du nombre de contaminations dans les cinq à dix années à venir placent d’emblée cette épidémie comme une des plus graves maladies infectieuses et l’un des plus difficiles défis du XXIe siècle. Les pays en voie de développement les plus touchés sont les plus pauvres et le SIDA va induire une régression de l’espérance de vie majeure, inhibant tous les efforts portés ces trente dernières années. L’accès aux traitements constitue un enjeu majeur que les pays riches ne peuvent sous-estimer. Les recherches fondamentales, cliniques et thérapeutiques menées dans des pays comme la France constituent désormais un enjeu de politique internationale. La situation de l’épidémie en France ne montre qu’une stabilisation du nombre de nouveaux cas diagnostiqués, montrant que la moitié est liée à une contamination hétérosexuelle et qu’une forte proportion de ces sujets est au stade SIDA du fait d’une absence de dépistage antérieur. Parmi les cas de SIDA, la proportion de sujets originaires d’un pays d’Afrique sub-saharienne est en augmentation. La complexité de cette infection est liée à de nombreux éléments impliquant particulièrement la très grande diversité génétique des VIH et leur mécanisme spécifique d’infection et de destruction du système immunitaire.

1. Les VIH
Les VIH appartiennent au groupe des rétrovirus, lesquels ont été identifiés dans de nombreuses espèces de mammifères, incluant les lentivirus, les oncovirus et les spumavirus. Ce sont des virus enveloppés, à ARN qui possèdent une reverse-transcriptase. Cette enzyme spécifique permet de transformer l’ARN viral en ADN double brin (provirus) lequel peut s’intégrer dans le chromosome de la cellule et induire une infection définitive de l’organisme. Les VIH font partie des lentivirus responsables d’infections persistantes à évolution lente, bien connues en pathologie vétérinaire (ex : le virus Visna responsable de l’arthrite de la chèvre, le virus responsable de l’anémie équine). Les oncovirus sont aussi des retrovirus responsables de diverses pathologies animales ; ils diffèrent des lentivirus par leur capacité à induire chez leurs hôtes des tumeurs ou des leucémies. Chez l’homme, les HTLV font partie de ce groupe des oncovirus. Leur pouvoir pathogène est bien différent de celui des lentivirus, puisque l’on estime qu’un pour mille à un pour dix mille sujets infectés par ces virus risque de développer une leucémie; alors que le risque de développer une pathologie classante chez un sujet infecté par VIH-1 est proche de 98%.

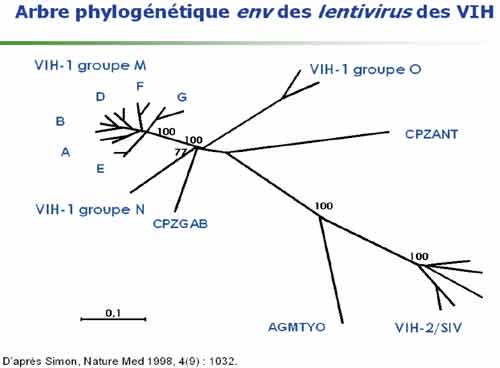
1-1. La diversité génétique des VIH
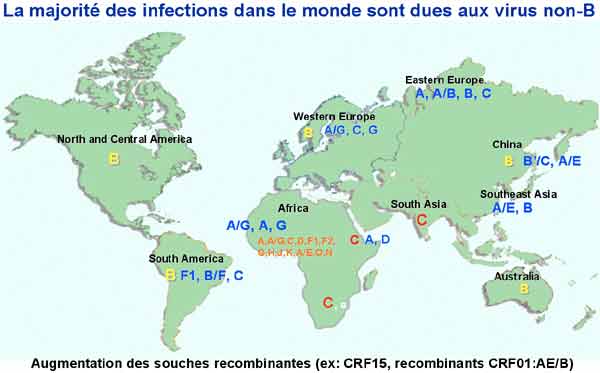
Elle est importante à souligner car elle constitue un obstacle majeur à la constitution d‘un vaccin préventif et peut poser des problèmes de diagnostic et de prise en charge thérapeutique. On distingue deux groupes de VIH : les VIH-1 proches des virus des chimpanzés africains et comprenant les VIH –1 groupe M, groupe O et groupe N. Ce sont les VIH-1 groupe M (major) qui sont largement dominants avec une grande diversité génétique au sein de ce groupe incluant les principaux sous-types (de A à K), tous présents en Afrique. De plus, de nombreux virus recombinants sont régulièrement identifiés et caractérisés ; ils sont particulièrement présents en Afrique dont ils sont aussi originaires et peuvent donc être identifiés chez les sujets d’origine africaine vivant en France. Alors que le sous-type B du groupe M est majoritaire en Europe et aux Etats-Unis, le sous-type C est dominant dans le monde du fait du développement très important de l’épidémie en Afrique sub-saharienne.
Les VIH-2 proches des virus des singes mangabey montrent aussi une grande diversité, mais celle-ci est moins forte que celle des VIH-1, sans doute du fait d’un moindre pouvoir pathogène des VIH-2 et donc d’une extension relativement plus faible de cette épidémie. La plupart des sujets infectés par le VIH-2 vivant en France sont d’origine africaine (Afrique de l’Ouest).
1-2. Structure et réplication virale
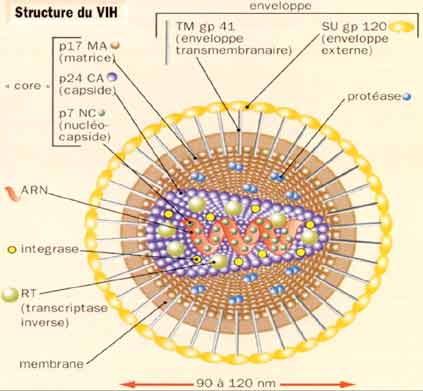
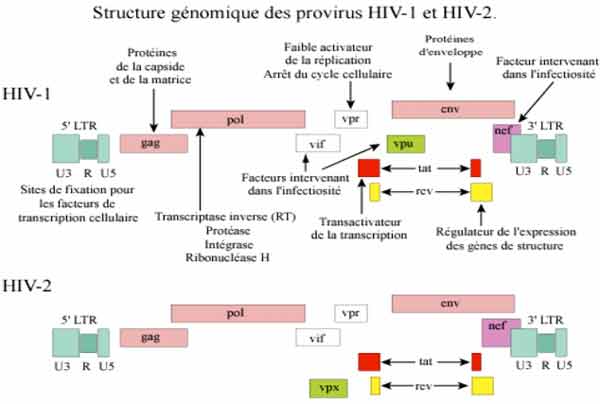
Les VIH sont des virus enveloppés, et l’enveloppe virale est constituée de deux glycoprotéines qui sont particulièrement étudiées car responsables des premières étapes de l’attachement du virus aux cellules (recherche vaccinale et thérapeutique). Le génome viral est présent au sein du core viral sous forme de deux molécules d’ARN identiques et associées aux enzymes virales : la reverse-transcriptase, l’intégrase et la protéase, lesquelles constituent des cibles spécifiques pour les traitements antirétroviraux. Les VIH ont une organisation génomique complexe comprenant en plus des gènes de structure gag, pol et env, six gènes de régulation de la réplication virale.
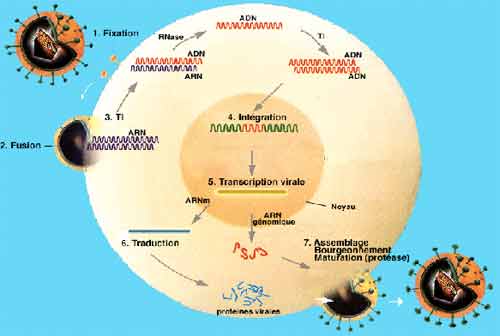
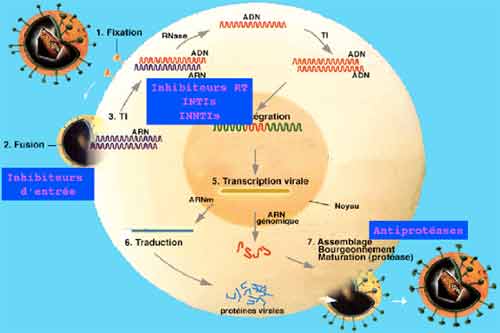
La connaissance des différentes étapes du cycle réplicatif des VIH est essentielle pour la compréhension de la physiopathologie de l’infection, chacune de ces étapes étant une cible potentielle des thérapeutiques antivirales. La première étape correspond à l’adsorption et la pénétration du virus dans la cellule, cette étape met en jeu des récepteurs cellulaires, tels que la molécule CD4 présente à la surface des lymphocytes T CD4+ qui sont principales cellules-cible des VIH. D’autres récepteurs du virus ont été identifiés, il s’agit pour la plupart de récepteurs aux chimiokines tels que CCR5 ou CXCR4 ayant une capacité sélective vis à vis des différents types de virus (lymphotropes ou monocytotropes). Ces récepteurs sont aussi présents sur les monocytes/macrophages qui représentent une part non négligeable du réservoir viral.
La deuxième étape consiste en la transformation de l’ARN viral en ADN double brin qui est transporté du cytoplasme vers le noyau de la cellule sous forme de complexe de pré-intégration. L’intégration du provirus dans le chromosome cellulaire se fait grâce à l’intégrase virale : l’infection de la cellule est définitive car le provirus est une forme virale très stable au sein du génome cellulaire. La durée de vie du provirus est identique à celle de la cellule infectée. Dans le sang périphérique, le nombre moyen de lymphocytes infectés est de l’ordre de mille sur un million de cellules mononuclées circulantes; cependant, la majorité des lymphocytes infectés se situent dans le tissu lymphoïde qui constitue la plus grosse partie du réservoir viral C’est l’activation du lymphocyte infecté qui va déclencher les étapes suivantes de la réplication virale, lesquelles vont conduire à la synthèse des protéines virales qui, après auto-assemblage, vont constituer des particules virales qui sortiront de la cellule par bourgeonnement. La production de très nombreux virus par une cellule infectée conduit à la mort de la cellule par effet lytique du virus.
Plusieurs conséquences de cette réplication virale au sein des lymphocytes T CD4 méritent d’être soulignées :
- La synthèse de particules virales se fait dans tout territoire de l’organisme contenant des lymphocytes T CD4 activés, tout particulièrement dans les follicules lymphoïdes ganglionnaires, déversant des virus infectieux dans tous les liquides biologiques incluant notamment le sang circulant, les sécrétions cervico-vaginales, le sperme, le LCR et le lait maternel (avec des conséquences directes en terme de risque de transmission par voie sexuelle ou de la mère à l’enfant).
- La réplication virale au sein de l’organisme est persistante et continue : c’est le rôle des lymphocytes CD4 de répondre aux signaux d’activation immunitaire, lesquels sont quasi constants au sein de l’organisme. En l’absence de triatemnt la détection d’ARN VIH plasmatique est donc quasi constante.
- Les antirétroviraux ont pour rôle de bloquer l’une ou l’autre des étapes de la réplication virale et de limiter la production de nouvelles particules virales et l’infection de nouvelles cellules. A ce jour, aucune des molécules disponibles ne permet d’atteindre les provirus et ni d’éradiquer l’infection. Les traitements antirétroviraux ne sont que virustatiques et toute interruption thérapeutique conduit à la reprise de la réplication virale à partir des provirus.
1-3. Physiopathologie de l’infection à VIH
Les conséquences directes de la réplication du VIH au sein de l’organisme sont la diminution lente et progressive du nombre de lymphocytes CD4 pendant plusieurs années. Au début de l’infection, la réplication virale est faible et la production thymique de CD4 compense les pertes liées à la lyse des cellules ou aux effets des cellules cytotoxiques sur les cellules infectées. La réponse immunitaire spécifique contrôle la réplication virale de façon partielle puisqu’elle laisse un niveau résiduel différent pour chaque patient qui peut être estimer par le taux d’ARN VIH plasmatique (de quelques centaines de virus à quelques millions). Pour chaque sujet, un équilibre immuno-virologique spécifique s’établit dès la primo-infection. Au stade Sida et en fin de maladie, la réplication virale est élevée et n’est plus contrôlée : les pertes en CD4 ne sont plus compensées. Il s’installe donc progressivement un déficit quantitatif en CD4 auquel s’ajoute un déficit qualitatif de nombreuses fonctions du système immunitaire conduisant au déficit immunitaire constitutif du SIDA. En quelque sorte, on peut dire que le VIH a trouvé le refuge « idéal » dans les cellules les plus importantes du système immunitaire : les lymphocytes T CD4 mémoires à longue durée de vie et qui sont protégés par le système immunitaire lui-même, puisque son rôle est de préserver la mémoire immunitaire. De plus, la persistance du virus dans l’organisme se fait non seulement par la réplication virale dans des cellules productrices qui conduit à l’infection de nouvelles cellules, mais aussi par la division cellulaire des cellules mémoires contenant du provirus.
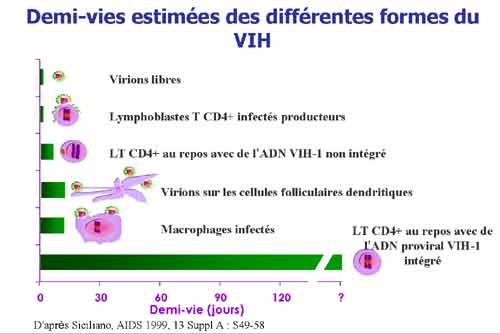
L’infection de l’organisme est donc définitive, elle va persister toute la vie du sujet infecté. L’équilibre immuno-virologique de chaque patient est reflété par un taux de virus relativement stable même s’il progresse régulièrement au fur et à mesure que le taux de CD4 diminue. La mise en réserve continue et régulière de provirus dans des cellules infectées latentes à longue durée de vie constituent un réservoir viral extrêmement stable et persistant. C’est ce réservoir viral qui est à l’origine de la production de virus en l’absence de traitement ou lors des interruptions thérapeutiques.
Après la primo-infection, la réponse immunitaire anti-VIH s’établit progressivement avec notamment l’apparition d’une réponse immunitaire cellulaire et celle d’anticorps anti-VIH détectables 3 à 6 semaines après la date présumée de contage, conduisant au contrôle progressif de la réplication virale (diminution du pic de virémie). Dès le début de l’infection, le risque de progression vers le sida s’établit de façon différente d’un sujet à l’autre selon le niveau d’infection de l’organisme. Il peut être élevé et la réplication virale est alors importante, alors que chez certains sujets dits « asymptomatiques à long terme » l’évolution de l’infection peut être particulièrement lente. Plusieurs facteurs associés au risque de progression ont été identifiés : il s’agit de facteurs liés au virus (ex : taux de virus, capacité réplicative, tropisme) et de facteurs génétiques et immunitaires.

2. Le diagnostic de l’infection à VIH
Le diagnostic indirect ou sérologique de l’infection repose sur la détection des anticorps sériques ; il reste dans la majorité des cas la démarche diagnostique la plus pertinente et la plus accessible.
2-1. Les tests de dépistage et de confirmation
Les tests de dépistage : les méthodes immuno-enzymatiques de type ELISA sont actuellement les méthodes de référence pour mettre en évidence les anticorps sériques. Les tests homologués en France permettent de détecter des anticorps anti-VIH-1 du groupe M et du groupe O, ainsi que les anticorps anti-VIH-2. Les trousses actuelles sont sensibles et spécifiques. La législation française actuelle impose l’utilisation de deux tests sérologiques différents, combinant ainsi deux capacités à détecter des primo-infections et des infections dues à des virus variants.
Des tests combinés antigène-anticorps associent un test ELSA pour la détection des anticorps à un test ELISA pour la détection de l’antigène de capside p24. Ils permettent la détection des premières phases de la primo-infection. Les tests rapides font appel à des techniques d’agglutination ou d’adsorption des complexes antigène-anticorps sur membranne. Ils peuvent être faits en moins d’une heure. Ils constituent un excellent recours en cas d’urgence, mais ils offrent un risque de moindre sensibilité notamment en cas de primo-infection.
La spécificité des tests ELISA est élevée, de l’ordre de 99,2 à 99,8 %. Cependant, en cas de réaction positive un test de confirmation reste obligatoire, permettant d’identifier les différents anticorps et de poser un diagnostic définitif d’infection, ou au contraire de l’exclure. La technique de référence est le Western-blot : un sérum est considéré comme positif pour VIH-1 lorsqu’il présente au moins un anticorps dirigé contre une protéine d’enveloppe (gp120, gp41) associé à au moins un anticorps dirigé contre une protéine interne du virus (protéine de core : p55, p24, p17) ou une protéine enzymatique (p68, p51, p34). L’interprétation des Western-blots spécifiques du VIH-2 suit les mêmes règles. Les Laboratoires d’Analyses Médicales se doivent de suivre l’algorithme général de l’ANAES pour le diagnostic de l’infection par le VIH.


2-2. Diagnostic de l’infection chez un sujet adulte
L’intérêt du dépistage précoce de l’infection à VIH est majeur pour pouvoir initier une prise en charge avant l’instauration de déficit immunitaire. En première intention, il faut prescrire un test de sérologie VIH, avec le consentement du patient et une information complète sur la signification des résultats des tests. En cas de résultats positifs, un deuxième prélèvement apportera la confirmation de la séropositivité et permettra de prescrire un test d’ARN VIH plasmatique. La confidentialité des résultats reste indispensable, qu’ils soient négatifs ou positifs. Enfin, il faut rappeler qu’un test peut être obtenu de façon anonyme et gratuite dans les CDAG (Centres de dépistage anonyme et gratuit). La prescription d’un test de Western blot pour une confirmation de séropositivité reste la règle et un test montrant la présence de tous les anticorps anti-VIH (Western blot dit complet) est plutôt évocateur d’une infection ancienne.
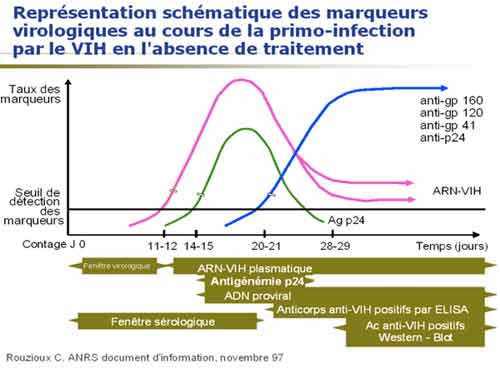
2-3. Diagnostic d’une primo-infection
En présence de symptômes évocateurs d’une primo-infection à VIH, ou en cas de notion d’exposition récente à l’infection, la prescription de la sérologie VIH doit être associée à celle de l’ARN VIH plasmatique, ou à défaut à celle de la recherche d’ag p24. Un deuxième prélèvement effectué dans un délai de quinze jours à trois semaines pourra permettre de montrer une éventuelle évolution sérologique (le mieux est qu’il soit adressé dans le même laboratoire pour être testé dans les mêmes conditions). Un profil de Western blot incomplet est évocateur d’une infection récente. Au moment d’une primo-infection à VIH, le taux d’ARN-VIH plasmatique est généralement élevé (100 000 à quelques millions de copies d’ARN VIH soit 5 à 7 log10 copies/mL), cependant il est variable d ‘un sujet à un autre et peut être bas (1000 à 100 000 copies d’ARN VIH soit 3 à 4 log10 copies/mL) chez certains sujets.

2-4. Diagnostic de l’infection de l’enfant né de mère séropositive
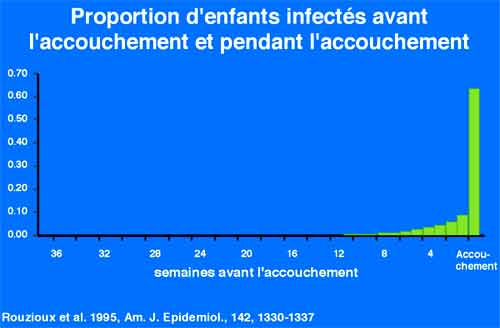
Le risque de transmission du virus de la mère à l’enfant est lié au taux de virus maternel et au risque de transmission virale par micro-transfusions en fin de grossesse ou par contamination de l’enfant lors du passage dans la filière génitale. En l’absence de traitement le risque de transmission du virus à l’enfant est de l’ordre de 20 %, il est réduit à moins de 1 % en cas de traitement antirétroviral préventif administré à la mère et dans les premières semaines de vie du nouveau-né. En France, le test VIH est systématiquement proposé en début de grossesse, il permet une prise en charge de la très grande majorité des grossesses VIH en France.
Le diagnostic de l’infection à VIH chez un enfant né de mère séropositive se fait différemment selon l’âge auquel sont effectués les prélèvements sanguins.
Diagnostic de l’infection à VIH-1 chez le nouveau-né : Le diagnostic utilise les techniques de détection du virus puisque la présence d’anticorps maternels empêche toute approche sérologique jusqu’à l’âge de 16-18 mois. La recherche du virus peut se faire par PCR ADN à partir des cellules sanguines pour la recherche de génome viral intégré, ou par détection de l’ARN VIH plasmatique avec les techniques habituellement utilisées pour le suivi de patients séropositifs. La recherche de virus par culture reste intéressante en cas de virus atypiques ou variants non reconnus par les techniques moléculaires. Il s’agit le plus souvent d’infections survenant chez des femmes d’origine africaine ; pour faciliter le diagnostic chez le nouveau-né, il est parfois nécessaire d’adresser un prélèvement maternel en cours de grossesse au laboratoire de virologie qui réalisera le diagnostic, afin qu’il puisse sélectionner les techniques adaptées au virus maternel avant de les appliquer aux échantillons de l’enfant (exemple : infection par un virus VIH-1 Groupe O).
En l’absence de traitement de l’enfant, les sensibilités des deux techniques de PCR ADN et ARN VIH plasmatique sont équivalentes. Pour poser le diagnostic d’infection il est nécessaire d’avoir deux prélèvements positifs, ce quelle que soit la technique utilisée. Inversement pour poser un diagnostic de non-infection il faut deux prélèvements négatifs.
En cas de traitement préventif de la transmission virale, le diagnostic est peu fiable tant que l’enfant est sous traitement antirétroviral. Il faut donc deux prélèvements négatifs hors période de traitement pour considérer un enfant comme non infecté. Les prélèvements précoces, naissance et premières semaines de vie, peuvent être informatifs en cas de résultats positifs, ils permettent notamment d’affirmer une infection in utero en cas de positivité dès la naissance.
En cas d’allaitement maternel, il est nécessaire de rechercher l’infection dans les trois mois qui suivent l’arrêt définitif de l’allaitement. Cette situation peut se rencontrer chez des nourrissons d’origine Africaine.
En cas d’infection à VIH-2, seules les techniques de PCR ADN utilisant des amorces spécifiques de VIH-2 sont à privilégier, du fait que la technique de mesure de l’ARN VIH-2 plasmatique n’a pas été évaluée dans le contexte du diagnostic de l’enfant. Les mêmes règles de prescription que celles décrites pour VIH-1, en soulignant la nécessité des deux prélèvements négatifs pour affirmer une non infection et celle de deux prélèvements positifs pour un diagnostic d’infection.
Diagnostic de l’infection à VIH au-delà de l’âge de 18 mois : Les techniques sérologiques permettent de détecter la réponse anticorps de l’enfant, elles peuvent être utilisées selon le même algorithme que celui utilisé pour le diagnostic de l’infection de l’adulte.

3. Le rôle du laboratoire de Virologie dans le suivi de l’infection
3-1. Les tests de mesure de l’ARN VIH plasmatique et le suivi virologique
La présence de l’ARN viral dans le plasma témoigne d’une réplication virale constante dans l’organisme. Le niveau initial est variable selon les sujets, il constitue l’un des déterminants de risque de progression vers un déficit immunitaire. En début d’infection et en l’absence de contexte thérapeutique, il convient de faire un suivi régulier impliquant la prescription de ce test deux fois par an. La mesure de l’ARN VIH plasmatique permet aussi de suivre l’efficacité d’un traitement antirétroviral : trois à quatre mois de traitement sont nécessaires pour réduire le taux d’ARN VIH plasmatique jusqu’à l’indétectabilité. Il est préférable de faire réaliser le suivi virologique avec la même technique du fait de différences entre les tests actuellement disponibles.
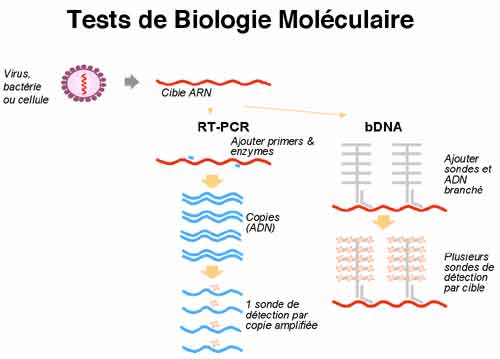
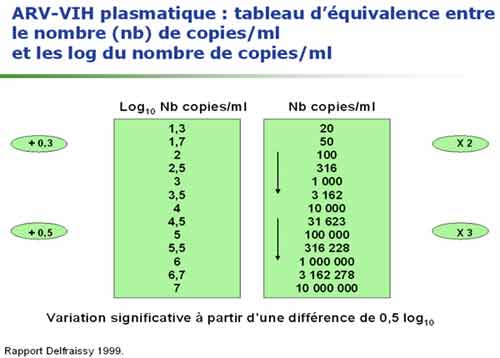
Deux tests sont majoritairement utilisées en France. La trousse Amplicor HIV Monitor (Roche Diagnostic System) est un test de RT-PCR dont le seuil de la technique est de 400 copies/mL (ou de 40 copies/mL après concentration virale par ultra-centrifugation). La trousse Quantiplex HIV RNA (Bayer) utilise une technique dite d’ADN branché (hybridation de l’acide nucléique et amplification du signal d’hybridation) ; son seuil est de 50 copies d’ARN VIH/mL. Le test LCx (Abbott) est récent et donc encore peu utilisé actuellement en France, il présente l’avantage de permettre la quantification des virus du groupe 0. Aucun de ces tests ne permet la quantification des VIH-2 (test réalisé uniquement en laboratoires spécialisés). La détection de virus variants peut être différente selon les techniques et poser des difficultés. Il peut être intéressant de discuter avec le biologiste du contexte clinique en cas de résultat négatif ou discordant de l’évolution clinique : l’indication de l’origine africaine du patient ou d’une suspicion d’une infection par le VIH-2 (Afrique de l’Ouest) peut orienter le biologiste dans le choix des tests à utiliser. Les résultats peuvent être exprimés en nombre de copies d’ARN VIH par mL de plasma ou en log10 de ce nombre de copies/mL. Quelque que soit la technique d’ARN VIH utilisée, la variabilité de la mesure est estimée à 0,3 log, on considère qu’une évolution de la charge virale n’est significative que si elle atteint un facteur 3 en expression arithmétique ou 0,5 en expression logarithmique.
3-2. Les tests de résistance aux antirétroviraux
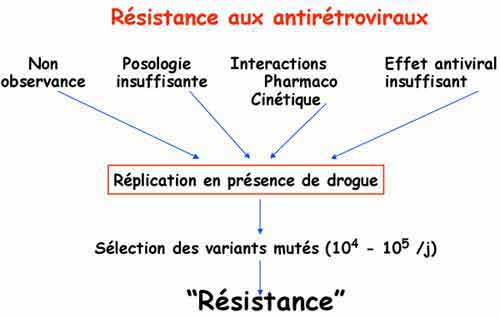
En cas d’échec thérapeutique, le risque de développement de virus résistants aux traitements augmente avec le temps, particulièrement en cas de réplication résiduelle élevée malgré les antirétroviraux. Les phénomènes de résistance sont liés à la sélection de virus mutés du fait d’une pression antirétrovirale insuffisante. Les virus résistants portent des mutations dans les gènes codant pour les enzymes virales, cibles des traitements. Les mutations dans les gènes entraînent des modifications de structure et de fonction de ces enzymes virales dont les interactions avec les antirétroviraux s’en trouvent modifiées, limitant puis bloquant leur effet antiviral. La sélection de virus résistants est donc principalement observée en cas de concentrations sub-optimales d’antiviraux. Le phénomène est d’autant plus important que le niveau de réplication est élevée.
La recherche de virus résistants constitue une étape indispensable pour un changement éventuel de traitement. Les tests pour la recherche de résistance aux antirétrovirux utilisent la technique de séquençage des gènes cibles pour l’identification de codons mutés ou non. L’identification de l’ensemble des mutations dans le gène de la RT (reverse-transcriptase) et dans celui de la protéase permet de définir et de choisir les traitements qui sont les plus à même de réduire la réplication virale. Les zones affectées par ces mutations peuvent être les mêmes pour certaines classes d’antirétroviraux induisant des résistances croisées. L’interprétation des résultats est complexe et basée sur un algorithme déduit à partir de résultats de différents essais thérapeutiques. Chaque nouvelle molécule fait l’objet de nouvelles recherches tant in vitro que in vivo. L’ensemble de ces recherches conduisent à la définition et à la mise à jour régulière de cet algorithme d’interprétation, analysant les différentes associations de mutations pouvant induire une résistance à l’une ou l’autre des molécules qui ont été utilisées par le patient.
L’analyse des séquences des gènes de RT et de protéase se fait à partir du virus plasmatique dont on extrait puis séquence l’acide nucléique viral. Ces tests sont réalisés dans les laboratoires de virologie, ils nécessitent une certaine expertise tant sur le plan technique que sur l’interprétation des résultats. Les règles de prescription des test virologiques sont régulièrement mises à jour et éditées au sein des recommandations nationales. Les recommandations nationales (et internationales) préconisent l’utilisation des tests de résistance pour optimiser les traitements antiviraux en fonction des différentes situations cliniques. La mise à jour de l’algorithme est effectuée très régulièrement en France et l’algorithme 2003 est disponible sur le site web du Groupe Résistance de l’ANRS. Il mentionne les règles d’interprétation des résultats pour chaque médicament de chacune des différentes classes d’antirétroviraux : les INTI (inhibiteurs nucléosidiques de la transcriptase-inverse), les NNRTI (inhibiteurs non nucléosidiques et nucléotiduiques de la transcriptase-inverse) et les IP (inhibiteurs de la protéase).
Les résultats des tests génotypiques de résistance doivent être analysés parallèlement à ceux des dosages pharmacologiques des médicaments et en fonction de chaque situation clinique et histoire thérapeutique. Ils sont indissociables de l’estimation de l’observance du traitement. Le risque d’induire des résistances aux traitements ne doit pas être sous-estimé, il nécessite une forte adhésion du patient à son programme thérapeutique et ceci sur plusieurs années.
La mise à disposition de nouvelles molécules telles que les inhibiteurs d’entrée du virus dans la cellule implique le développement de nouveaux tests de résistance qui concernent d’autres gènes cibles (glycoprotéine d’enveloppe).

|
|
|
|
|
