
| Objectifs du cours : - Connaître les principales pathologies provoquées par les staphylocoques et notamment par Staphylococcus aureus. - Connaître les principaux facteurs de pathogénie de S. aureus - Connaître les principaux critères bactériologiques conduisant à l’identification des staphylocoques. - Connaître leur capacité à développer des résistances aux antibiotiques. |
1 - Introduction
Les Staphylocoques sont des Cocci à Gram positif classiquement disposés en amas. Actuellement, on distingue 44 espèces. L’espèce S. aureus (plus communément appelé staphylocoque doré) se distingue généralement des autres staphylocoques appelés staphylocoques à coagulase négative (SCN) par la présence d’une coagulase. S. aureus est un germe très important aussi bien dans les infections communautaires que nosocomiales.
2 -Habitat
Le réservoir naturel des staphylocoques est l’homme et les animaux à sang chaud. Cependant, éliminées dans le milieu extérieur, ces bactéries très résistantes sont fréquemment retrouvées dans l’environnement.
Le site de colonisation préférentielle de S. aureus chez l’homme est la muqueuse nasale. En effet, 30% des adultes hébergent S. aureus de façon permanente, 50% de façon intermittente et 20% ne sont jamais porteurs. A partir des sites de portage, S. aureus colonise les territoires cutanés en particulier, les zones humides (aisselles, périnée) et les mains.
Les SCN représentent les principaux commensaux de la peau avec les corynébactéries et les propionibactéries. La densité de colonisation est plus importante au niveau des zones humides comme la partie antérieure des narines, le périnée, les creux axillaires et les plis inguinaux. Ils peuvent aussi être isolés des muqueuses. S. epidermidis est l’espèce la plus fréquemment isolée. Ainsi, S. epidermidis peut contaminer les prélèvements superficiels ou les prélèvements obtenus par ponction transcutanée comme les hémocultures.
La transmission intra ou interhumaine s’opère généralement par contact direct (manuportage). Plus rarement, elle peut être indirecte à partir d’une source environnementale (vêtements, draps, matériels médicaux).
3- Pouvoir pathogène
|
Il est important de distinguer S. aureus des SCN. S. aureus a un potentiel de pathogénicité très important et est responsable aussi bien d’infections communautaires que nosocomiales. Par opposition, les SCN sont en règle générale des bactéries opportunistes essentiellement responsables d’infections nosocomiales. 3.1. S. aureus : Il est responsable d’infections suppuratives superficielles et profondes ainsi que de syndromes liés à l’action de toxines. |
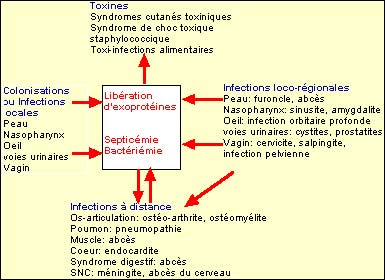 |
Infections suppuratives superficielles et profondes
Les infections suppuratives impliquent la prolifération bactérienne, l’invasion puis la destruction des tissus de l’hôte, la réponse inflammatoire locale et systémique. S. aureus est principalement responsable d’infections suppuratives loco-régionales.
|
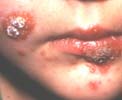
Les infections à S. aureus les plus fréquentes sont les infections cutanéo-muqueuses telles que les folliculites, impétigo, furoncles, anthrax, panaris, cellulites ou les sinusites et les otites. Il s’agit le plus souvent d’auto-infestations. |
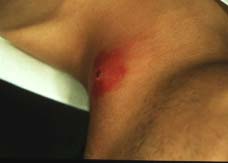 |
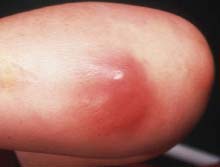 |
Ces infections se compliquent parfois par extension loco-régionale de l’infection, ou par diffusion hématogène de la bactérie. S. aureus peut alors être responsable de septicémies, d’endocardites, de pneumopathie, d’ostéomyélites, d’arthrites, de méningites ou d’infection urinaire.
La gravité des septicémies à S. aureus tient tant au risque de survenue de choc staphylococcique qu’à la localisation de métastases septiques.
Une des complications des septicémies à S. aureus est la survenue d’endocardite infectieuse. Les septicémies des toxicomanes utilisant la voie intraveineuse peuvent être à l’origine d’endocardite du cœur droit.
Les pneumopathies staphylococciques sont rares mais graves en raison du risque de complications à type d’abcès, de nécrose pulmonaire extensive (cf infra chapitre spécifique) ou d’évolution vers des pleurésies enkystées.
Les ostéomyélites aiguës touchent le plus souvent les os longs chez les enfants et les vertèbres chez les adultes. De même, contrairement à ce que l’on observe chez les adultes, les arthrites septiques chez les enfants peuvent être associées à une ostéomyélite adjacente du fait de la présence de vaisseaux sanguins au niveau de l’épiphyse. S. aureus tient également une place dominante dans les infections ostéo-articulaires post-chirurgicales, d’inoculation ou après traumatismes.
Les méningites peuvent se produire, soit par contiguïté à partir d’une sinusite ou après un traumatisme facial, soit par voie hématogène, par exemple à partir d’une endocardite.
S. aureus peut aussi être responsable d’infections urinaires. La contamination se fait soit par voie ascendante sur sonde à demeure soit par voie hématogène.
Infections non suppuratives d’origine toxinique
Les toxémies staphylococciques sont l’apanage de l’espèce S. aureus : syndromes cutanés staphylococciques, choc toxique staphylococcique et intoxication alimentaire. Elles peuvent être dues à la diffusion de toxines à partir d’un foyer infectieux ou d’un site de colonisation (exfoliatines, toxine du choc toxique staphylococcique TSST-1). Dans ce cas, la toxine est produite in vivo. Par opposition, les intoxications alimentaires sont dues à l’ingestion d’une toxine préformée dans un aliment contaminé.
Syndromes cutanés staphylococciques
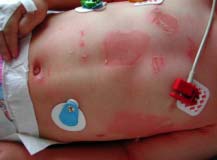
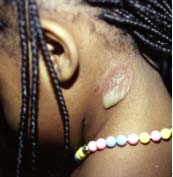
Le syndrome de la peau ébouillantée chez les jeunes enfants (Staphylococcal Scalded Skin Syndrome) est provoqué par la diffusion d’exfoliatines. Ce syndrome est appelé syndrome de Ritter chez les nouveaux-nés. Le foyer inititial peut être ORL, conjonctival ou cutané. Ce syndrome se rencontre dans la grande majorité chez le jeune enfant mais peut aussi se rencontrer chez l’adulte immunodéprimé et les patients atteints d’insuffisance rénale. Le syndrome d’exfoliation généralisée se caractérise par une érythrodermie douloureuse, rapidement suivie d’un décollement bulleux généralisé régressant en 2 à 4 jours. Le staphylocoque n’est pas présent au niveau des bulles. L’évolution bénigne, favorisée par un traitement antibiotique ne doit pas faire oublier le risque d’évolution mortelle estimé à environ 4% en cas de retard de traitement antibiotique.
| Syndrome d’exfoliation généralisée :
syndrome de Ritter ou
de la peau ébouillantée
|
 |
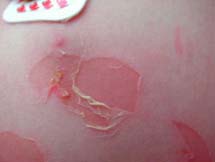 |
|
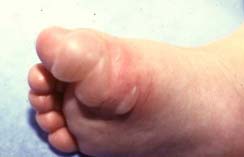
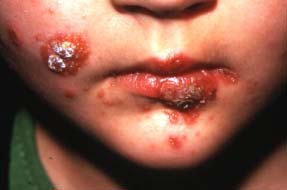
Par opposition au SSSS, l’impétigo bulleux est induit par la production d’exfoliatines au sein même des lésions cutanées. Il est constitué d’un nombre variable de bulles prédominantes aux extrémités à contenu trouble contenant le staphylocoque et la toxine (exfoliatine). Les bulles évoluent vers l’ouverture et la formation d’ulcérations puis de croûtes. La cicatrisation se fait en une semaine environ.
|
 |
 |
| Impétigo staphylococcique non toxinique |
 |
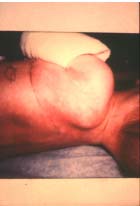
Choc toxique staphylococcique
|
Le syndrome de choc toxique staphylococcique est provoqué par la diffusion dans l’organisme de la toxine (TSST-1) et/ou des entérotoxines. La forme clinique complète de ce syndrome associe une fièvre supérieure à 39°C, une hypotension artérielle, une érythrodermie scarlatiniforme généralisée suivie 7 à 14 jours après d’une desquamation intense et d’une atteinte multi-viscérale. La mortalité est de l’ordre de 10 %. Cette pathologie a initialement été décrite en pédiatrie comme une complication d’infection suppurative staphylococcique. Depuis, de nombreux cas ont été rapportés, notamment lors de complication d’infections postopératoires ou encore chez des femmes en période menstruelle lors de l’utilisation de tampons vaginaux. Dans ce dernier cas, il n’existait pas de foyer d’infection suppurative à S. aureus. C’était la présence de tampon qui favorisait la production de TSST-1 par des souches de S. aureus colonisant le vagin. |
 |
| A côté de cette forme classique, d’autre formes cliniques incomplètes sont décrites : la scarlatine staphylococcique, le NTED (Neonatal toxic shock syndrome-like Exanthematous disease) et le REDD syndrome (Recalcitrant Erythematous Desquamating Disorder). La scarlatine staphylococcique est caractérisée par une fièvre et un érythème scarlatiniforme typique en 48 heures suivi d’une fine desquamation, sans choc ni défaillance multi-viscérale. Exemple: Scarlatine staphylococcique |
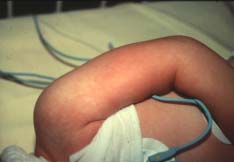 |
Le NTED est caractérisé par la survenue lors de la période néonatale d’une fièvre, d’une éruption cutanée et d’une trombocytopénie (en l’absence de choc et d’autre signe de défaillance multiviscérale). Le REDD syndrome, décrit chez des patients sidéens, est caractérisé par la survenue d’une fièvre, des lésions scarlatiniformes et d’une défaillance multi-viscérale mais sans état de choc.
Intoxications alimentaires
Elles sont provoquées par l’ingestion d’entérotoxines. Ces toxines thermostables sont produites par les souches de S. aureus contaminant l’aliment. Les aliments le plus souvent incriminés sont les produits laitiers et la viande. L’intoxication est caractérisée par une incubation courte (1 à 6 heures après ingestion), des crampes abdominales douloureuses, des diarrhées, des vomissements et l’absence de fièvre. L’évolution est le plus souvent favorable en l’absence de traitement mais la survenue de choc toxique staphylococcique est possible lors d’une intoxination massive. En fonction des études, les intoxications alimentaires à S. aureus représenteraient 15 à 30% des toxi-infections alimentaires.
Pathologie associée à la leucocidine de Panton Valentine (LPV)
Cette toxine est ainsi dénommée car elle est capable de détruire les leucocytes. Elle est produite par moins de 3% des souches de S. aureus. Elle est classiquement associée aux infections cutanées staphylococciques primitives, notamment la furonculose chronique, et dans la survenue de pneumonie nécrosante. La pneumonie nécrosante touche principalement le grand enfant et le jeune adulte. Elle est précédée d’un syndrome infectieux d’allure virale durant quelques jours puis la survenue d’une détresse respiratoire aiguë avec hémoptysies. Les patients deviennent souvent leucopéniques au cours de l’infection. La gravité de la pneumonie nécrosante est attestée par le très haut taux de mortalité (75% avec une médiane de survie de 4 jours). La LPV pourrait en outre être associée à d’autres formes particulièrement sévères d’infections staphylococciques.
Maladies possiblement liées aux toxines staphylococciques
En dehors de ces pathologies, les toxines superantigéniques staphylococciques pourraient être impliquées dans l’étiologie du syndrome de Kawasaki, la mort subite du nourrisson et semblent au moins représenter un facteur aggravant de l’eczéma atopique.
3.2 Staphylocoques à coagulase négative
La majorité des staphylocoques à coagulase négative sont des bactéries opportunistes essentiellement responsables d’infections nosocomiales. Trois facteurs favorisent ces infections : l’immunodépression, la présence de cathéters veineux ou de matériaux prothétiques, la multirésistance des SCN aux antibiotiques. S. epidermidis est l’espèce la plus fréquemment isolée en milieu hospitalier.
S. epidermidis peut provoquer des infections chez les sujets porteurs de matériel étranger (cathéter intra-vasculaires, prothèses ostéo-articulaires, boîtiers de stimulation cardiaque, valves de dérivation du liquide céphalo-rachidien…). La production d’exopolysaccharides augmente sa capacité d’adhésion aux biomatériaux et va empêcher la pénétration des antibiotiques, rendant leur éradication difficile. S. epidermidis est aussi responsable de septicémies notamment dans les services d’oncologie et de néonatologie, de péritonites chez les patients en dialyse péritonéale, d’endocardites surtout chez les sujets porteurs de prothèse valvulaire cardiaque, d’infections sur valve de dérivation du liquide céphalo-rachidien. Plus rarement, cette espèce est responsable d’infections sur prothèse orthopédique, de cystites et de pyélonéphrites.
S. haemolyticus est la seconde espèce responsable d’infections humaines, en particulier de suppurations, d’infections urinaires et de septicémies.
Au sein des SCN, deux espèces sont responsables d’infections communautaires : S. saprophyticus par ses capacités à adhérer à l’épithélium vésical provoque des cystites chez les jeunes femmes et S. lugdunensis est responsable d’infections cutanées et d’endocardites infectieuses.
4 - Physiopathologie
Le pouvoir pathogène d’une souche est lié à l’expression de facteurs de virulence. Nous aborderons dans ce chapitre uniquement le cas de S. aureus dont les facteurs de virulence sont les mieux caractérisés. On distingue les protéines de surface (adhésines) qui permettent la colonisation de l’hôte, des facteurs qui conduisent au développement et à l’extension de l’infection et des toxines spécifiques responsables de syndromes toxiniques.
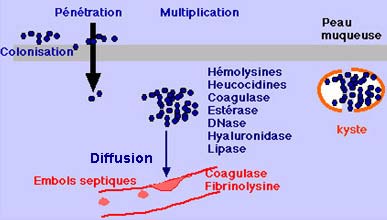 |
 |
4.1 Protéines de surface: colonisation
Pour qu’une bactérie colonise un tissu, il faut au préalable qu’elle y adhère. Cette étape est déterminante dans le développement ultérieur de l’infection. S. aureus colonise la peau et les muqueuses en adhérant aux cellules et aux composants de la matrice extra-cellulaire. La colonisation s’observe en dehors de toute lésion préalable. Elle est cependant favorisée par toute effraction de la barrière cutanéo-muqueuse.
Plusieurs constituants staphylococciques interviennent dans ce phénomène. S. aureus possède un grand nombre de protéines exposées à la surface de la bactérie et qui ont la capacité de se fixer sur des molécules de l’hôte. On parle d’adhésines. Un certain nombre de ces adhésines appartiennent à la famille des MSCRAMM (Microbial Surface component Recognizing Adhesive Matrix Molecule) c’est-à-dire qu’elles reconnaissent les molécules de la matrice extra-cellulaire. La matrice extra-cellulaire est composée de molécules interagissant entre elles et avec les cellules environnantes. Elle est composée de collagène, d’élastine, de protéoglycanes et de glycoprotéines de structure telles que la fibronectine.
Plus d’une dizaine d’adhésines ont été identifiées, les mieux caractérisées sont :
- La protéine A :
Elle est considérée comme une MSCRAMM car elle se lie au facteur de von Willebrand. Le facteur de von Willebrand est un peptide présent au niveau de l’endothélium lésé. La protéine A peut de ce fait jouer le rôle d’une adhésine au début d’une infection intra-vasculaire. De plus, la protéine A possède deux domaines de liaison aux immunoglobulines : un fixant le fragment Fc (partie constante) et l’autre le fragment Fab (partie variable). L’interaction protéine A-fragment Fc des immunoglobulines interfère avec l’opsonisation anticorps-dépendant tandis que l’interaction protéine A-fragment Fab entraîne une activation polyclonale des lymphocytes B. La protéine A se comporte ainsi comme un superantigène pour les lymphocytes B.
- La protéine de liaison au collagène de type I, II et IV :
Cette adhésine joue un rôle très important dans les infections ostéo-articulaires.
- La protéine de liaison à la fibronectine :
Cette protéine contribue à l’adhérence de S. aureus aux caillots plasmatiques mais aussi aux biomatériaux ayant un contact prolongé avec le sang. Elle joue un rôle très important dans l’initialisation des infections sur corps étrangers. Elle serait impliquée dans les phénomènes d’internalisation du staphylocoque dans la cellule endothéliale, cette étape prenant part à la physiopathologie des endocardites infectieuses à S. aureus.
- Les protéines de liaison au fibrinogène: Clumping factor (ClfA, ClfB)
Le clumping factor est un récepteur pour le fibrinogène qui provoque l’agrégation des bactéries en présence de plasma. Cette adhésine joue un rôle dans les infections des plaies et les infections sur corps étranger. Il semble que le ClfB soit fortement impliqué dans la colonisation nasale.
Ainsi, les adhésines permettent à S. aureus de fixer des molécules plasmatiques (fibrinogène, fibronectine) ou tissulaires (collagène) et jouent un rôle primordial dans la colonisation des tissus.
L’adhésion bactérienne est par ailleurs favorisée par les acides lipoteichoiques.
4.2 Facteurs protégeant la bactérie de la phagocytose
Quatre vingt dix pour cent des souches cliniques de S. aureus produisent une capsule composée d’exopolysaccharides. Les exopolysaccharides ainsi que la protéine A protègent la bactérie de la phagocytose favorisant ainsi l’extension de l’infection.
La coagulase se lie à la prothrombine et forme un complexe appelé staphylothrombine. Le complexe staphylothrombinique entraîne la polymérisation du fibrinogène en fibrine et la formation d’un caillot protégeant ainsi la bactérie de la phagocytose.
4.3 Facteurs conduisant à l’extension de l’infection.
Extension locale
S. aureus produit plusieurs toxines ayant pour cible les membranes cellulaires. Ces toxines se fixent à des cellules cibles et provoquent la formation de canaux membranaires laissant passer les ions (pore-forming toxins). On peut citer les hémolysines a, b, D et les toxines synergohmynenotropes.
L’hémolysine-alpha pour cible la cellule endothéliale, les monocytes et les thrombocytes. La destruction des cellules endothéliales favorise la dissémination des bactéries et les métastases septiques à distance.
La famille des toxines synergohyménotropes est composée par les leucocidines et l’hémolysine. Ces toxines sont composées de deux protéines agissant en synergie pour créer des pores dans les membranes cellulaires de différentes cellules eucaryotes. Les leucocidines et en particulier la leucocidine de Panton et Valentine (LPV) ont pour cible les polynucléaires, les monocytes et les macrophages. La LPV a une action leucotoxique et dermonécrotique mais n’est pas hémolytique. La LPV est impliquée dans les infections cutanées nécrosantes (furoncle, anthrax) et dans certaines infections graves (pneumonie nécrosante, ostéomyélite). L’inhibition des fonctions phagocytaires et la destruction des granulocytes expliquent l’extension des lésions. On peut aussi citer la leucocidine lukE-D. L’hémolysine-g se fixe sur les érythrocytes mais aussi sur les leucocytes. Elle est hémolytique et leucotoxique. Une forte proportion des souches de S. aureus produit la g-toxine (99 %) alors que seulement 2% des souches expriment la LPV.
L’hémolysine béta et l’hémolysine delta créent aussi des lésions cellulaires. L’hémolysine béta est une sphingomyélinase qui altère les membranes riches en lipides (action phospholipase de type C) et l’hémolysine delta possède des propriétés détergentes.
Les autres enzymes produites par S. aureus capables de dégrader le tissu conjonctif comme les protéases, l’élastase et la hyaluronidase, favorisent l’extension du foyer infecté.
Diffusion hématogène
La diffusion hématogène de S. aureus à partir du foyer primaire se fait probablement par le biais de thrombophlébites locales où la coagulase joue un rôle majeur. La coagulase se lie à la prothrombine et forme un complexe appelé staphylothrombine. Ce complexe staphylothrombinique entraîne la polymérisation du fibrinogène en fibrine et ceci aboutit à la formation de thrombus. La staphylokinase est un activateur du plasminogène en plasmine et exerce un effet inverse à celui de la coagulase. Elle conduit à la dislocation du thrombus qui est très riche en bactéries et ainsi à la formation de localisation septiques secondaires.
4 .4 Toxines responsables de syndromes spécifiques
S. aureus sécrète de nombreuses toxines, cependant très peu sont responsables de pathologies spécifiques. Il s’agit des entérotoxines, des exfoliatines A et B, et de la TSST-1.
Ces toxines agissent à distance du foyer infectieux et possèdent une activité biologique commune, l’activité superantigénique. Ces sont des toxines capables d’induire une activation polyclonale des lymphocytes T indépendamment de leur spécificité antigénique. Ceci a pour conséquence une libération massive de cytokines (tumor necrosis factor alpha et béta, interleukine 1 et 6, interféron g), la sensibilisation des monocytes aux endotoxines et les lésions de l’endothélium expliquant la survenue d’hypotension et du choc staphylococcique (fièvre, hypotension, hémorragie). La majorité des souches de S. aureus produisent une ou plusieurs toxines superantigéniques.
La TSST-1 est impliquée dans le choc toxique staphylococcique, la scarlatine staphylococcique, le NTED et le REDD syndrome.
Les entérotoxines sont impliquées dans les intoxications alimentaires (ingestion d’aliments contenant une entérotoxine), le choc toxique staphylococcique et la scarlatine staphylococcique. Ce sont des protéines thermostables résistantes aux protéases intestinales qui comprennent de nombreux types antigéniques (A à E et G à R). Cependant, l’activité émétique n’a pas été prouvée pour tous les types antigéniques.
Les exfoliatines sont des métalloprotéines qui ont pour cible l’épiderme (clivage intraépidermique). Elles se fixent sur un composant des desmosomes, la desmogleine 1 uniquement exprimée par les kératinocytes situé au niveau de la couche granuleuse de l’épiderme. Son action provoque donc sur le plan histologique un décollement entre le stratum granulosum et le stratum spinosum créant cliniquement des lésions bulleuses. Elles sont responsables du syndrome d’exfoliation généralisé (syndrome de peau ébouillantée chez l’enfant ou syndrome de Ritter chez le nouveau-né). Une forme mineure d’expression de ces exfoliatines est l’impétigo bulleux localisé. Chez l’homme, trois types antigéniques sont actuellement décrits (A, B et D). L’exfoliatine D a été décrite récemment à partir d’une souche isolée dans une plaie cutanée et pas dans un cadre d’exfoliation généralisée ni d’impétigo bulleux. De plus, elle semble largement représentée au sein des souches. Son rôle en pathologie reste donc à confirmer par de nouvelles études.
Par ailleurs, toutes ces toxines par leur activité superantigénique jouent probablement un rôle dans les maladies auto-immunes du fait de leur capacité à induire une activation de lymphocytes auto-réactifs (dirigés contre les antigènes du soi). Il semble que ce soit le cas dans la maladie de Kawasaki, la dermatose atopique, le psoriasis et certaines arthrites.
5 - Diagnostic biologique
Examen direct
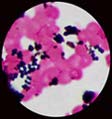
| Après coloration de Gram, les staphylocoques apparaissent comme des cocci à Gram positif. Ils peuvent être isolés, en diplocoques ou en amas. Les amas sont les plus caractéristiques du genre staphylocoque. Amas de staphylocoque après coloration de Gram |
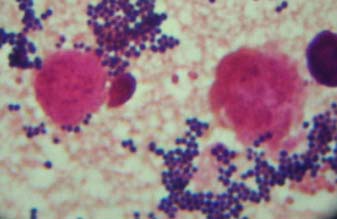 |
L’examen direct du prélèvement s’il est possible donne une orientation diagnostique importante. En effet, l’association de cocci Gram positif et de polynucléaires dans un prélèvement évoque fortement une infection à staphylocoque. Cependant, le diagnostic définitif du genre et de l’espèce ne sera obtenu qu’après la culture et l’identification des souches.
Caractères culturaux
|
Les staphylocoques se développent rapidement à 37°C sur les milieux usuels. La plupart des souches de S. aureus élaborent un pigment qui donne une couleur jaune-orangé aux colonies (à gauche). Colonies de S.epidermidis (à droite). |
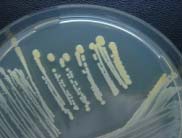 |
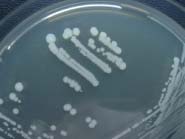 |
Diagnostic de genre et d’espèce
Catalase
La catalase est un caractère quasi-constant chez les staphylocoques. La mise en évidence de la catalase permet de distinguer parmi les cocci à Gram positif les staphylocoques et les streptocoques.
Coagulase
| Le test mettant en évidence l’aptitude des bactéries à coaguler le plasma est le principal test caractérisant S. aureus. Le test de détection consiste à incuber pendant 4 heures à 37°C un mélange de plasma de lapin et de la souche à tester. L’apparition d’un caillot est observée en inclinant le tube à 90°C. Le test de la coagulase permet l’identification de 99% des souches de S. aureus mais certaines souches ne produisent pas de coagulase. L’identification de l’espèce est dans ce cas réalisée par d’autres tests. |
 |
Tests d’agglutination
 |
Plusieurs tests d’agglutination détectant un ou plusieurs antigènes ou récepteurs de surface (récepteur pour le fibrinogène, protéineA, antigènes capsulaires) sont commercialisés. En pratique, il est recommandé d’utiliser deux tests pour l’identification de S. aureus : la détection de la coagulase et un test d’agglutination. Toute discordance entre les deux devra conduire à une identification biochimique |
Identification biochimique
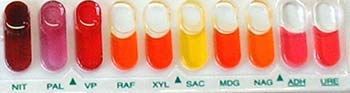
| La détermination de l’espèce peut être réalisée à l’aide de galeries biochimiques d’identification. Ces systèmes utilisent des tests d’acidification ou d’assimilation des sucres (A) et des tests enzymatiques (B).
Ils sont partiellement ou totalement automatisés. Ces galeries sont utilisées essentiellement pour l’identification des staphylocoques à coagulase négative. |

|
Les staphylocoques et en particulier les staphylocoques à coagulase négative font partie de la flore naturelle de l’organisme. Ainsi, l’interprétation devra toujours tenir compte du site d’isolement de la bactérie, des signes cliniques et cytologiques d’infection (présence de polynucléaires). Il sera généralement nécessaire de répéter les prélèvements ; l’isolement répété de la même souche étant un argument en faveur d’une infection.
6 - Sensibilité aux antibiotiques
|
Les staphylocoques peuvent être sensibles à divers antibiotiques mais se caractérisent par une aptitude remarquable à acquérir de multiples caractères de résistance. |
 |
S. aureus
Actuellement, environ 95% des souches sont résistantes à la pénicilline G, aux aminopénicillines, aux carboxypénicillines et aux uréidopénicillines.
Les souches communautaires sont, en général, sensibles à la pénicilline M (méticilline, oxacilline) qui reste l’antibiotique de choix. Elles sont le plus souvent sensibles aux macrolides, aminoglycosides, fluoroquinolones et synergistines. Depuis quelques années, nous observons la diffusion de souches communautaires résistant à la méticilline; cependant ces souches restent minoritaires.
| En France, parmi les souches isolées en milieu hospitalier, 20 à 40% des souches sont résistantes à la pénicilline M. La France possède un des taux les plus élevés d’Europe. La méticillino-résistance s'accompagne d'une résistance à toutes les ß-lactamines ainsi qu'à d'autres antibiotiques dont les aminoglycosides (TM), les macrolides et apparentés (E, L), les synergistines (PT), les fluoroquinolones (FQ) ou encore la fosfomycine (FOS). |

|
Les glycopeptides, la rifampicine, l’acide fusidique sont, par ordre décroissant, les molécules qui restent le plus souvent actives sur ces souches. Ces souches sont plus communément appelées souches méti-R ou SARM (S. aureus Résistant à la Méticilline).
Depuis 1997, des souches présentant une sensibilité diminuée aux glycopeptides ont été décrites et elles sont plus communément appelées GISA (Glycopeptide Intermediate S. aureus). Le mécanisme mis en jeu semble lié à l’activation de la synthèse de la paroi bactérienne en l’absence des gènes van responsables de la résistance aux glycopeptides chez les entérocoques.
Deux souches de S. aureus résistantes aux glycopeptides et possédant le gène van ont été décrites aux Etats-Unis. Or, les glycopeptides sont des rares molécules utilisables dans les infections à SARM. Les linézolides (Zivoxid®) restent, en général, actifs sur les GISA.
Staphylocoques à coagulase négative
La multirésistance aux antibiotiques, notamment à la méticilline et aux aminoglycosides, est fréquemment rencontrée chez S. epidermidis et S. haemolyticus, fréquemment isolés en milieu hospitalier. Les antibiotiques de choix sont représentés par les glycopeptides, la rifampicine, les synergistines et l’acide fusidique. Les linézolides (Zivoxid®) sont habituellement actifs sur ces souches.
8 - Prophylaxie
|
La prophylaxie repose sur l’application des mesures d’antisepsie et d’hygiène individuelle (traitement des lésions pouvant représenter une porte d’entrée à des infections plus graves) et collective (lutte contre les infections dans les hôpitaux, surveillance des cuisines). |
  |
|
|
Le portage manuel est la base de la transmission directe interhumaine des souches notamment en milieu hospitalier. Les staphylocoques et en particulier les SARM peuvent coloniser les patients et les membres du personnel soignant ayant un contact direct avec les patients. |
Les SARM, du fait de leur multirésistance aux antibiotiques, se sont ainsi répandus en milieu hospitalier et sont fréquemment responsables d’infections nosocomiales. Le personnel soignant contribue largement à leur dissémination lorsque les mesures d’hygiène et d’isolement ne sont pas respectées. L’isolement des patients porteurs de SARM, associé au respect permanent des mesures d’hygiène (lavage des mains) contribuent à la diminution de l’incidence de ces souches. Ces mesures parallèlement à une utilisation raisonnée des antibiotiques sont indispensables à l’image de certains pays européens (pays nordiques) dans lesquels la prévalence des SARM est très basse (< 1%).
La détection de la colonisation à S. aureus associée à une décolonisation est de plus en plus préconisé en plus de l’antibioprophylaxie chez les patients devant subir une chirurgie orthopédique ou cardiaque.
Par ailleurs, la vaccination staphylococcique anti-S. aureus est proposé chez les patients hémodialysés.
Ce cours a été préparé par Isabelle Verdier1, Gérard Lina1, Yves Gillet1-2 et François Vandenesch1
1-Centre National de Référence des Staphylocoques, INSERM E0230, Faculté de Médecine Laennec, Lyon
2 -Service de Pédiatrie, Hôpital Edouard Herriot, Lyon
Pour en savoir plus :

Quelques adresses:
http://science.education.nih.gov/
http://www.invs.sante.fr/beh/2000/0023/
|
|
|
|
|