A. Le virus de la Rage
1 - Classification
Les virus de la famille des Rhabdoviridae (du grec rhabdos, baguette, d'après la forme "rectangulaire" du virion) font partie de l'ordre des Mononégavirales
- leur génome est un ARN non segmenté (Mono) de polarité négative (néga)
- ce sont des virus enveloppés (et par conséquent des virus fragiles)
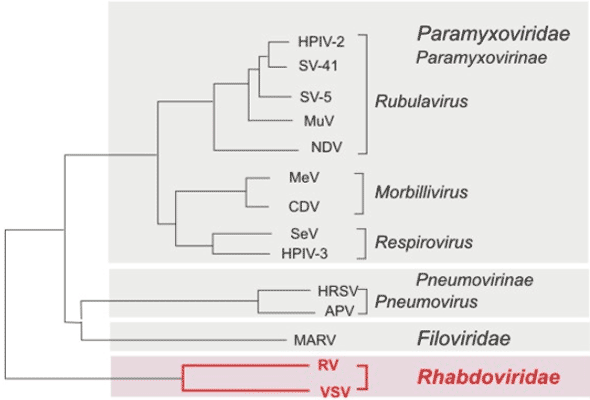
Figure 1 : Ordre des Mononegavirales. Arbre phylogénétique, établi à partir du gène de la polymérase, montrant les relations génétiques existant entre les différentes familles de cet ordre : Paramyxoviridae, Filoviridae et Rhabdoviridae. Abréviations : CDV= virus de la maladie de Carré (Canine distemper virus); HMPV= Métapneumovirus humain ; HRSV= virus respiratoire syncytial humain ; MARV= virus de Marburg ; MeV= virus de la rougeole ; MuV= virus des oreillons ; NDV= New Castle virus ; RV= virus de la rage (Lyssavirus) ; SeV= Sendai virus ; SV= virus simien ; VSV= virus de la stomatite vésiculaire (Vesiculovirus) (d’après Pringle and Easton avec modifications).
Les virus de la rage appartiennent au genre Lyssavirus (du grec lussa, la folie). La détermination de la séquence du génome viral codant la protéine N permet de définir 7 génotypes :
|
Génotype
|
Virus
|
Distribution géographique
|
espèces concernées
|
Efficacité du vaccin
|
| 1 | Rage classique | mondiale | Homme, carnivores sauvages et domestiques, chauves-souris. | oui |
| 2 | Lagos bat | Afrique | chauves-souris frugivores, chats, chiens. | non |
| 3 | Mokola | Afrique | Homme, musaraignes, chats, chiens, rongeurs. | non |
| 4 | Duvenhage | Afrique du Sud | Homme, chauves-souris insectivores. | non |
| 5 | EBL-1 | Europe | Homme, chauves-souris insectivores. | partielle |
| 6 | EBL-2 | Europe | Homme, chauves-souris insectivores. | oui |
| 7 | ABL | Australie | Homme, chauves-souris frugivores et insectivores. | oui |
– EBL = European Bat Lyssavirus (bat = chauve-souris) – ABL = Australian BL
2. Caractéristiques du virus
. Structure et composition
Les Rhabdovirus se présentent sous la forme d'un bâtonnet (Æ = 80 nm, longueur variable de 120 à 180 nm) avec une extrémité plate et l'autre arrondie, leur conférant un aspect en "balle de revolver" tout à fait caractéristique. Il existe des formes filamenteuses allant jusqu'à 300 nm.
Ce sont des virus enveloppés avec une nucléocapside à symétrie hélicoïdale.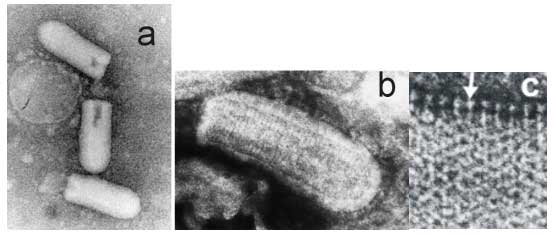
Figure 2 : (a) Aspect en microscopie électronique (coloration négative) d’un virus proche du virus de la rage, le virus de la stomatite (VSV). (b) Détail d’une particule virale et (c) des spicules au niveau de l’enveloppe (flèche). Cliché Pr. Pierre Lebon , laboratoire de Virologie, Hôpital Saint-Vincent de Paul, Paris.
. La nucléocapside
- Le génome
ARN de polarité négative, non segmenté et de 12 kb :
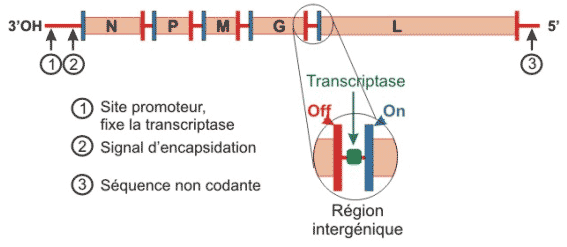
Figure 3 : organisation du génome des Rhabdovirus. N code la nucléoprotéine (protéine de capside) ; P code la phosphoprotéine (cofacteur de L) ; M code la protéine matrice ; G code la glycoprotéine ; L code la protéine large = ARN polymérase.
- La capside
La capside résulte de l'assemblage d'environ 2000 molécules de protéine N autour du génome, formant une nucléocapside de symétrie hélicoïdale qui prend l'allure d'un ressort condensé dans l'axe du virus.
Une cinquantaine de molécules du complexe Polymérase (ARN-polymérase L et co-facteur P) sont associées à la nucléocapside.. L’enveloppe
L'enveloppe recouvre la nucléocapside, elle est constituée :
La glycoprotéine G : Dans la double couche lipidique, d'origine cellulaire, sont insérées les spicules (trimères de la glycoprotéine G), assurant la fixation du virus aux récepteurs cellulaires. La glycoprotéine G induit des anticorps protecteurs car ils empêchent la fixation des virions aux récepteurs cellulaires.
La protéine matrice M : la protéine M forme une couche qui tapisse la face interne de l'enveloppe. Elle intervient dans l'assemblage du virion en réunissant les spicules et en condensant la nucléocapside en hélice.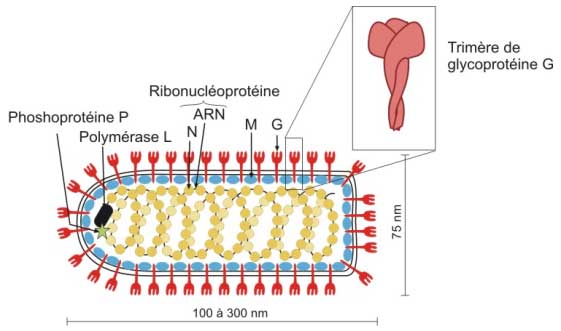
- le brin génomique d'ARN - et la protéine N qui le recouvre forment une nucléocapside hélicoïdale condensée en un ressort d'une quarantaine de spires et à laquelle plusieurs molécules L et P sont associées.
- la face interne de l'enveloppe est tapissée par la matrice (protéine M).
- la glycoprotéine G est insérée dans l'enveloppe sous forme de trimères (spicules) responsables de l'attachement et de la fusion.
3. Cycle de multiplication
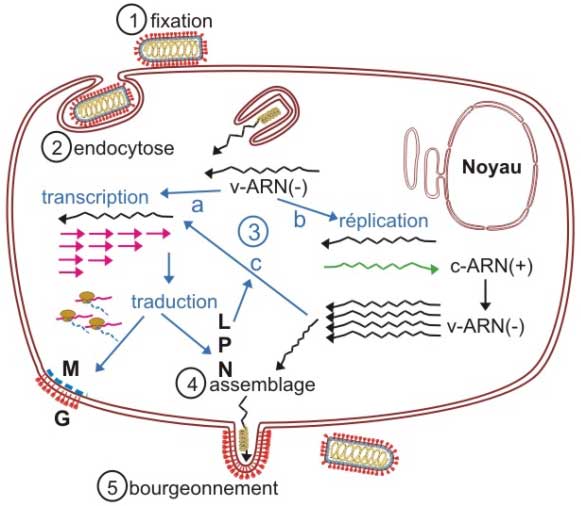
Figure 5 : Cycle de multiplication des Rhabdovirus. La totalité du cycle est intracytoplasmique.
a°- Fixation
Les spicules (trimères de G) se fixent aux récepteurs cellulaires.
Les récepteurs doivent être présents sur les nombreux types cellulaires sensibles à l'infection : tissus musculaire, nerveux, cutané, glandulaire (glandes salivaires, foie, reins).
Le récepteur nicotinique de l'acétylcholine (nAchR) serait important pour l'infection des cellules musculaires et des neurones par le virus rabique.
b°- Pénétration
Le virion est endocyté par la cellule :
L'acidification de l'endosome modifie la conformation de la glycoprotéine G qui acquiert des propriétés fusogéniques : l'enveloppe fusionne avec la membrane de l'endosome et la nucléocapside est libérée dans le cytoplasme.
c°- Phase des synthèses virales (éclipse)
i) l'expression du génome :
L'ARN viral (le v-ARN) est transcrit en ARN messagers qui sont traduits en protéines.
La libération de la nucléocapside dans le cytoplasme active les complexes de transcription [P + L] :![]()
- P, en reconnaissant le promoteur unique situé au début du génome, favorise le positionnement de L.
- la protéine L exerce 3 activités enzymatiques :
- ARN polymérase ARN dépendante : exerçant les deux activités transcriptase / réplicase,
- méthylase : pour la coiffe des ARN-messagers,
- poly A polymérase : pour la queue des ARN-messagers.
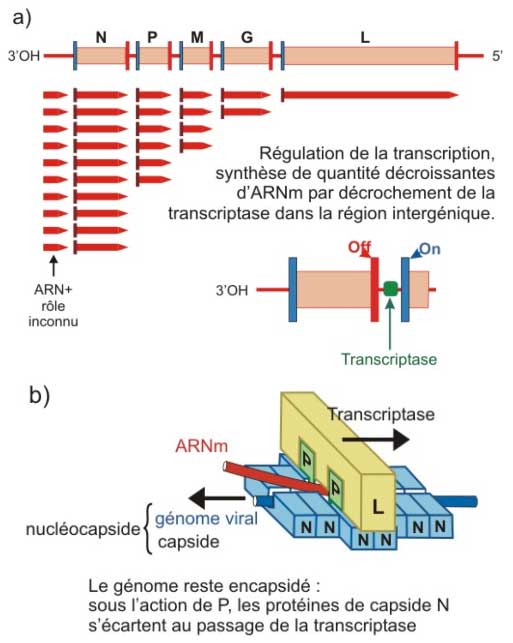
Figure 6 : Expression du génome du virus de la rage. a) Transcription des ARNm et b) détail du fonctionnement de la transcriptase. N = nucléoprotéine ; P = phosphoprotéine ; L = protéine large (ARN polymérase)
ii) Réplication du génome :
- d'abord, synthèse de matrices d'ARN + (l'antigénome ou c‑ARN).
- puis synthèse de nouveaux génomes (v-ARN) à partir de ces matrices.
iii) La transcription secondaire :
les nouveaux génomes sont transcrits en ARN messagers qui sont traduits en protéines de structure.
d°- Assemblage
Des vésicules ont transporté les spicules vers la région baso‑latérale de la membrane cytoplasmique avec laquelle elles fusionnent.
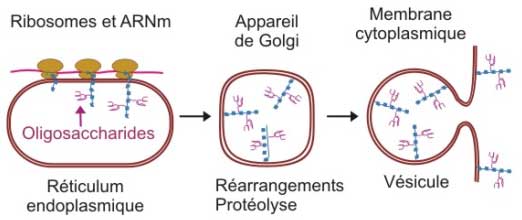
Figure 7 : Synthèse, glycosylation et transport des spicules virales (d’après White DO & Fenner FJ. Medical Virology, Academic press, 1994).
La protéine M se dépose sur la face interne de la membrane cytoplasmique. Elle interagit :
- avec l'extrémité des spicules qu'elle rassemble,
- avec les nucléocapsides dont elle assure la condensation sous la forme hélicoïdale caractéristique.
| Le mécanisme assurant cette sélection n'est pas connu. Nucléocapsides et virions s'amassent dans une matrice fibreuse et forment des inclusions pathognomoniques et caractéristiques observables au microscope optique : les corps de Negri (du nom du médecin italien, Adelchi Negri, qui a décrit cette lésion en 1903). |
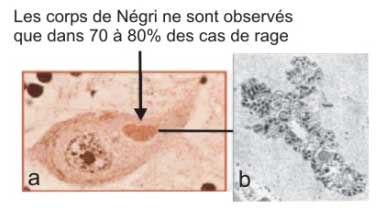 |
e° - libération
|
On peut observer : |
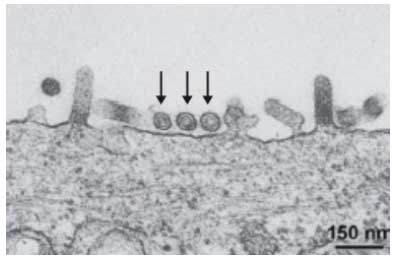 |
B. Epidémiologie de la rage
La rage est une zoonose, c'est à dire une maladie animale qui peut être transmise à l'homme : tous les animaux à sang chaud sont réceptifs à la rage.
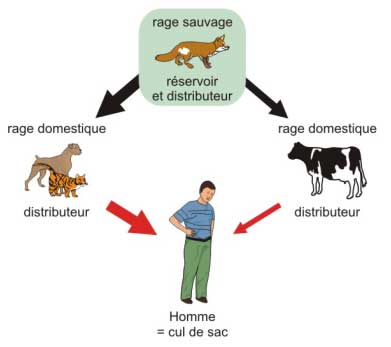
Figure 10 : La rage est une zoonose dont le réservoir est constitué par des vertébrés à sang chaud
De l’homme à l’animal, les conditions requises
a° des réservoirs de virus
Une zoonose ne peut exister que grâce à la permanence d'un réservoir animal : dans le cas de la rage, les réservoirs de virus sont des mammifères sauvages qui hébergent le virus pendant une très longue durée.
b° des distributeurs de virus (les vecteurs)
- les distributeurs primaires sont les réservoirs du virus : les animaux sauvages infectés deviennent excréteurs de virus dans la salive et le transmettent par morsure, soit à leurs congénères – ce qui entretient le réservoir – soit à d'autres animaux qu'ils rencontrent.
- les distributeurs secondaires sont les animaux domestiques mordus par les animaux sauvages excréteurs : chiens, chats, bovins, chevaux, qui n'ont pas été vaccinés...
c° des hommes
En général, le virus de la rage sera transmis à l'homme de façon accidentelle par inoculation de la salive virulente d'un animal enragé, sauvage ou domestique : par morsure et, plus rarement, par griffure ou par léchage d'une plaie ou d'une muqueuse.
![]() une fois déclarée, la rage est une encéphalite toujours mortelle.
une fois déclarée, la rage est une encéphalite toujours mortelle.
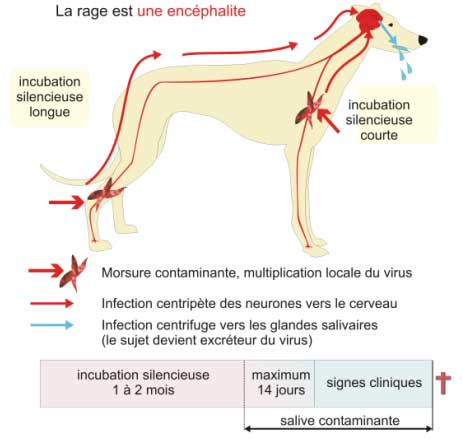
Figure 11 : Physiopathologie de la rage montrant le cheminement centripète plus ou moins long de l’infection vers le cerveau, puis le cheminement centrifuge vers les glandes salivaires aboutissant à la sécrétion du virus dans la salive.
Écologie de la rage animale
1° - la rage sauvage
Les virus de la rage se perpétuent dans deux grands cycles naturels :
a. la rage des carnassiers sauvages
La rage des carnassiers est présente sur tous les continents. Seuls quelques pays sont préservés par leur insularité et des mesures sanitaires draconiennes à leurs frontières : Grande-Bretagne, Japon, Australie, Îles du Pacifique.
Les vecteurs du virus, varient selon les pays : le renard roux en Europe, le raton-laveur et la moufette en Amérique du Nord, le chacal en Afrique, le loup au Moyen-Orient, la mangouste en Afrique du Sud...
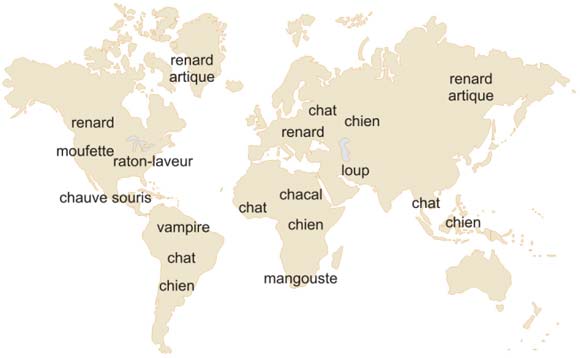
Figure 12 : Les réservoirs-distributeurs de la rage dans le monde
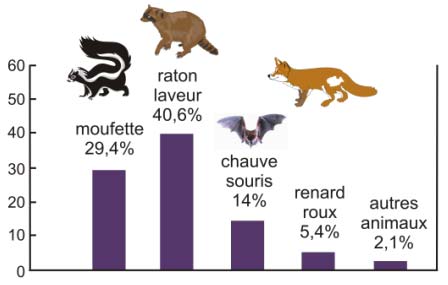
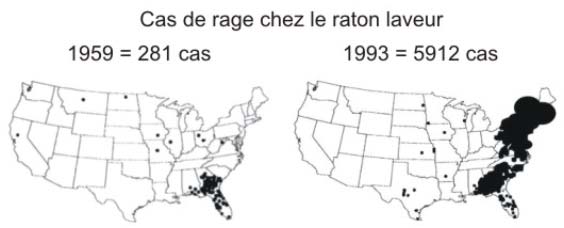
Figure 13 : La rage sauvage aux USA
b. la rage des Chiroptères
Chez les chauves-souris – des mammifères volants – la rage se présente le plus souvent comme une infection chronique : elles peuvent excréter le virus dans la salive et les urines pendant de longues périodes, ce qui en fait des distributeurs primaires potentiellement redoutables. En fonction des espèces, les chauves-souris peuvent être infectées par différents virus du genre Lyssavirus et la situation est variable selon les continents. Les virus du génotype 1 (virus de la rage classique à partir duquel se prépare le vaccin) ne sont retrouvés que chez les chiroptères du continent américain. Les virus de génotypes 2 et 4 sont retrouvés chez les chiroptères africains et le génotype 7 en Australie.
En Europe, les génotypes 5 et 6 sont les seuls retrouvés chez les chauves-souris autochtones, qui sont toutes insectivores. L’espèce qui semble la plus touchée parmi les 33 espèces est la Sérotine commune. En France, toutes les espèces sont protégées.
- la rage des chauves-souris est présente dans la majeure partie du globe, y compris dans les pays indemnes de la rage des carnivores terrestres tels que la Grande-Bretagne et l'Australie.
- les chauves-souris hématophages (les vampires) d'Amérique latine sont responsables de la rage paralytique du bétail, tuant chaque année plusieurs centaines de milliers d'animaux.
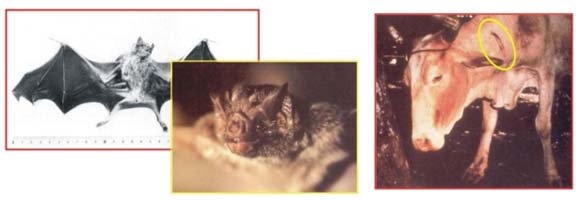
Figure 14 : A gauche, chauves souris hématophage (vampire) enragées. A droite, morsure de vampire sur une vache.
|
Les chauves-souris constituent le quart des mammifères de la planète avec près de 1 000 espèces, dont une trentaine en Europe. |
2° - la rage urbaine ou « rage des rues »
  Figure 15 : Chiens errants en Inde |
Les chiens constituent le réservoir et le vecteur principal du virus dans le monde. |
La contamination humaine
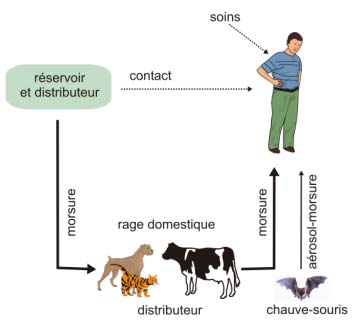
Figure 16 : les modes de contamination de l’homme
1 - la voie cutanée
![]() Notion capitale : la peau saine est une barrière infranchissable pour le virus rabique.
Notion capitale : la peau saine est une barrière infranchissable pour le virus rabique.
La contamination humaine par voie cutanée est la modalité la plus fréquente (99 %). Elle résulte :
- le plus souvent de la morsure par un animal enragé et excréteur de virus, et, plus rarement :
- d'un léchage sur une plaie fraîche, une peau excoriée,
- d'une griffure (chat) par des griffes souillées de bave,
- de la manipulation d'un animal enragé (mort ou vivant).
![]() le virus peut franchir les muqueuses
le virus peut franchir les muqueuses
le léchage ou la projection de gouttelettes de salive virulente sur les muqueuses conjonctivale, olfactive ou labiale présente un risque théorique plus grand que le léchage de la peau excoriée.
2 - la voie aérienne
il s'agit d'une modalité exceptionnelle :
l'inhalation d'un aérosol de particules virales (qui sont ensuite véhiculées par le nerf olfactif) est tout à fait exceptionnelle :
- visite d'une grotte habitée par des colonies importantes de chauves-souris (1 cas aux États-Unis). Dans cette situation, les chauve-souris volant dans tous les sens, des contacts percutanés ne sont cependant pas exclus.
- manipulations au laboratoire (2 cas)
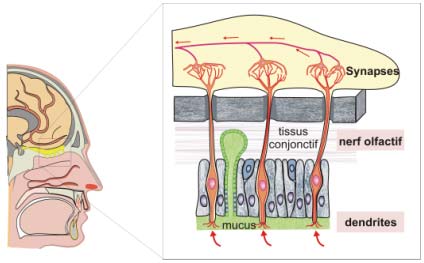
Figure 17 : mode de diffusion du virus par voie aérienne
3 - les soins à un homme enragé
la transmission interhumaine est théoriquement possible (mais n’a jamais été démontrée) : c'est pour cette raison qu'à la suite de deux cas de rage hospitalisés en phase terminale en France, il a fallu pratiquer respectivement 143 et 36 traitements "post exposition" parmi le personnel soignant et l'entourage des patients.
4 - les greffes de cornée d’un donneur en incubation de rage
il s'agit d'une transmission interhumaine exceptionnelle : huit cas dans la littérature (dont deux en France).
Les précautions d’hygiène universelles doivent être respectées, surtout celles concernant la protection contre les aérosols de salive (manœuvres de réanimation, intubation, kinésithérapie respiratoire…)
La rage en France
1 - la rage humaine
En France, aucun cas de rage humaine contractée sur le territoire n'a été déclaré depuis 1924 et ce, malgré l'apparition de la rage vulpine (la rage du renard).
Cependant, 20 patients sont décédés de rage en France entre 1970 et 2003, suite à des morsures dans des pays d'enzootie canine (dont la moitié en Afrique du Nord).
L’importation illégale d’animaux de compagnie ou d’animaux d’élevage peut être source de cas dramatiques, par morsures le plus souvent.
enzootie : maladie contagieuse qui frappe les animaux d'une région. l'enzootie est l'équivalent animal de l'endémie
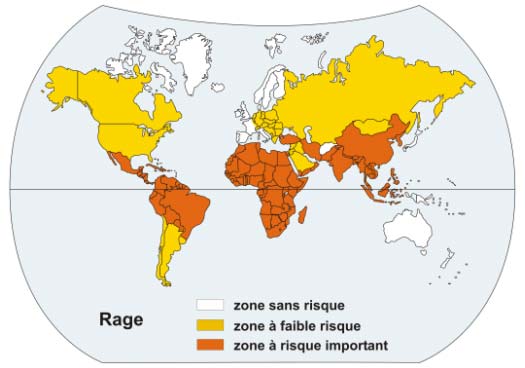
Figure 18 : Zones d’endémie de rage dans le monde
les enfants sont particulièrement exposés au risque, puisque 10 des 20 cas sont des enfants de 10 ans et moins (jeux avec des chiots…).
2 - la rage du renard
En Europe, le réservoir et vecteur de la rage a été, jusqu'en 1996, le renard :
Partie de la Pologne à la fin de la dernière guerre mondiale, la rage du renard a traversé le Rhin en mars 1968, progressant jusqu'à envahir le quart nord-est du pays. Le front de la rage vulpine s'est ensuite stabilisé. Pour l'année 2000, le ministère de l'Agriculture avait encore déclaré infectés par la rage cinq départements, proches de l'Allemagne.
Depuis le 30 avril 2001, la France a été officiellement déclarée indemne de rage – s'agissant des animaux terrestres – (il faut deux ans sans rage pour qu'un pays soit déclaré officiellement indemne de rage).
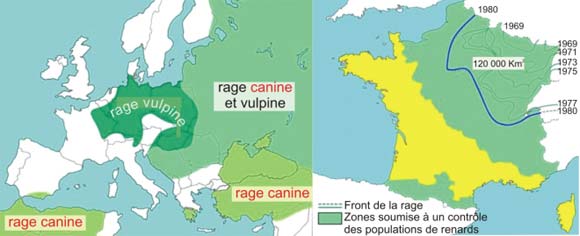
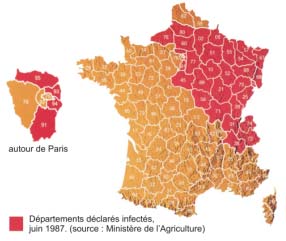
Figure 19 : Zone de diffusion de la rage en Europe.
Comment la France a-t-elle enrayé l'épizootie vulpine ?
Jusque 1986, on a utilisé conjointement deux tactiques :
1ère la vaccination des vecteurs secondaires :
on a pratiqué la vaccination des animaux domestiques puisque, dans plus de 90 % des cas, ce sont des animaux domestiques contaminés par le renard qui servaient de relais du virus vers l'homme.
2ème la diminution du réservoir de virus :
on a longtemps espéré qu'une diminution de la densité des populations de renards (par piégeage, empoisonnement, chasses...) permettrait la disparition de l'épizootie, un renard enragé ayant moins de chance de rencontrer un autre renard qu'il puisse contaminer.
En 1968 on recensait 10 renards par hectare, l’objectif était de descendre à 1 renard/ha.
Mais la dynamique de reproduction de l'espèce vulpine a déjoué cette tentative.
La vaccination des renards
En 1986, la France a mis en œuvre la vaccination orale des renards (déjà pratiquée avec succès en Suisse dès 1978) à l'aide de capsules contenant soit un virus vivant atténué, soit un vaccin génétique (le gène codant la glycoprotéine d’enveloppe est inséré dans le génome du virus de la vaccine). La préparation vaccinale est enrobée dans une couche de cire aromatisée au poulet.
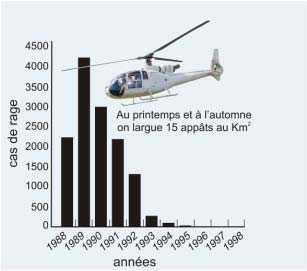 |
Figure 20 : Les campagnes de vaccination sont pratiquées deux fois par an : au printemps et en automne. On largue les appâts vaccinaux par hélicoptère à raison de 13 appâts par km2. Les résultats sur l’incidence annuelle de la rage animale en France ont été spectaculaires : > 4000 cas en 1989, 40 cas en 1995, 1 cas en 1998 |
C. PHYSIOPATHOLOGIE DE LA RAGE
1 - la pénétration du virus
Le virus de la rage est le plus souvent inoculé à son hôte lors de la morsure par un animal contaminé :
- il se multiplie d'abord dans les cellules musculaires.
- il pénètre dans le système nerveux par endocytose au niveau des terminaisons nerveuses libres et des jonctions neuromusculaires.
2 - l'invasion centripète du système nerveux
| Les virions sont transportés dans l'axone (par la dynéine) vers le corps cellulaire où le virus se multiplie. Les virions qui bourgeonnent du neurone infecté, sont libérés dans l'espace intersynaptique et infectent le neurone post-synaptique suivant. Le virus parvient au cerveau où il continue sa réplication. La maturation des nouveaux virions peut avoir lieu à la surface de la cellule et à l’intérieur du cytoplasme. |
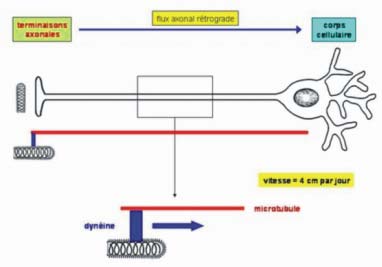 |
3 - la diffusion centrifuge à partir du cerveau
Le virus se dissémine ensuite dans tous les tissus par voie centrifuge, infectant les glandes salivaires mais aussi l'œil, les follicules pileux, le pancréas et les reins.

« le virus semble tuer l'organisme sans détruire la cellule…»
Bien que la présence du virus dans tous les neurones soit objectivée par la mise en évidence des antigènes rabiques, l'examen histologique ne révèle pas de lésions importantes. C’est le dysfonctionnement créé par la multiplication du virus, et non la mort du neurone, qui est responsable des signes cliniques et de la mort.
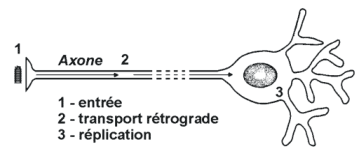
La stratégie mise en œuvre par le virus de la rage se révèle donc diabolique :
- au niveau de la morsure, la multiplication virale ne produit pas d'effet cytopathogène susceptible de présenter les antigènes viraux au système immunitaire.
- après s'être introduit dans le système nerveux il échappe, presque totalement, à la surveillance immunitaire de l'hôte. Les anticorps n'apparaissent qu'à la phase terminale de la rage.
- la multiplication du virus dans le cerveau, en particulier dans le système limbique (qui contrôle les émotions et le comportement), rend l'hôte agressif : condition indispensable de sa transmission à un nouvel hôte.
- dans le système nerveux les virions produits par un neurone infecté fusionnent immédiatement avec les neurones voisins sans provoquer de destruction cellulaire.
- par contre, dans les glandes salivaires, les virions formés par les cellules sont sécrétés dans la salive au même titre que le mucus, même en phase préclinique, d’où l’importance de la surveillance légale vétérinaire.
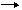 Le virus peut ainsi être transmis avant que son hôte ne meure...
Le virus peut ainsi être transmis avant que son hôte ne meure...
D. LA RAGE
La multiplication du virus dans le cerveau déclenche inexorablement une encéphalite mortelle dont l'expression clinique est variable :
- chez le renard
le renard, normalement très respectueux du « territoire» de ses voisins, devient agressif et contamine ses congénères.
Il perd sa méfiance habituelle et se rapproche de l'homme et de ses animaux domestiques, qu'il pourra contaminer par morsure.
Des animaux sauvages mordus par le renard peuvent également perdre leur méfiance habituelle et être à l'origine d'une contamination.
- chez le chien
la rage peut se présenter sous la forme furieuse (animal agressif, aboiement bitonal, hurlements rauques traduisant des signes laryngés) ou sous la forme paralytique avec atteinte d'emblée du train postérieur.

- chez le chat
la rage peut également se présenter sous la forme furieuse (et dans ce cas l'animal est particulièrement dangereux pour l'homme) ou sous la forme paralytique.
- chez les bovins
la forme paralytique est habituelle. Les premiers symptômes (salivation permanente, déglutition difficile) évoquent l'absorption d'un corps étranger : en tentant de l'extraire, l'homme risque de se contaminer.
- chez la chauve-souris
la chauve-souris change aussi de comportement (difficultés à voler, prostration). Les morsures peuvent passer inaperçues car elles sont de petite taille, indolores et situées dans des zones comme le cuir chevelu...
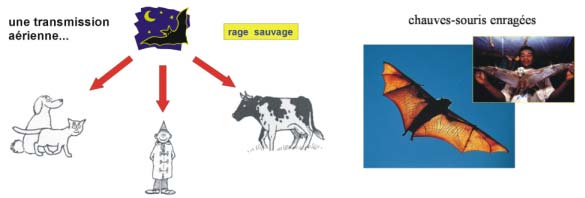

(Les étoiles indiquent les cas de rage affectant les chauve-souris en France)
- chez l’HOMME
L'incubation
L'incubation, totalement silencieuse, est en moyenne d’une durée de six semaines, mise à profit pour la sérovaccination (il importe d’aller plus vite que le virus).
La durée de l'incubation est raccourcie en cas de morsures profondes ou multiples de la face et des mains - régions riches en terminaisons nerveuses -
Chez l'enfant, la durée d'incubation est significativement plus courte que chez l'adulte. Du fait de leur taille, les enfants sont plus souvent mordus au visage.
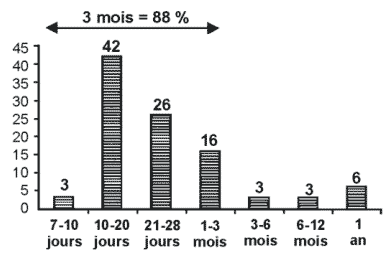
Inversement, l'incubation peut être exceptionnellement longue :
| en 1991, aux États-Unis, trois immigrants qui n'étaient pas retournés dans leur pays d'origine depuis respectivement 11 mois, 4 ans et 6 ans, sont décédés de la rage. Les souches isolées ont été trouvées proches des souches du Mexique, du Laos et des Philippines dont ils étaient respectivement originaires. Durées des incubations observées en Thaïlande chez 707 cas de rage humaine survenus entre 1979 et 1985. |
 |
Progression de la maladie
|
Phase
|
symptômes
|
durée
|
statut viral
|
statut immunologique
|
| Incubation | asymptomatique |
60 - 365 jours
|
multiplication du virus dans le tissu musculairepeu de virions | 0 (1) |
| Prodromes | fièvre, nausées, anorexie, douleur au niveau de la morsure |
2 - 10 jours
|
peu de virions dans le SNC et dans le cerveau | 0 (1) |
| Neurologique 1 | spasmes pharyngés, hydrophobie, hyperactivité, anxiété, dépression |
2 - 7 jours
|
titre en virions élevé | Anticorps dans le sérum et le SNC (LCR) |
| Neurologique 2 | Paralysie | |||
| Coma | coma, arrêtcardiaque, hypotension, hypoventilation |
0 - 14 jours
|
titre en virions élevé |
La période d'état : la phase encéphalitique
Caractérisée par l'apparition des signes neurologiques, cette période, habituellement fébrile, peut prendre trois aspects :
1° - la forme spastique (ou hydrophobique)
C'est la forme la plus classique et le plus fréquente.
Les signes caractéristiques sont d'ordre moteur : le malade est animé de mouvements involontaires, brusques, désordonnés, intéressant surtout le visage, mais aussi les membres. Ces mouvements interviennent dans la dynamique respiratoire (respiration hoqueteuse, pauses, soupirs, sanglots) et dans la déglutition (dysphagie spastique élective pour les liquides).
Ces spasmes sont accentués par les stimuli les plus variés : bruit, lumière vive, souffle d'air (aérophobie) ou tentative de déglutition des liquides.Le spasme hydrophobique est caractéristique de la rage humaine.
|
le spasme hydrophobique il s'agit d'un spasme pharyngo-laryngé et diaphragmatique douloureux avec rejet de la tête en arrière et hyperextension du tronc. La crise cède très vite mais laisse une impression de terreur si intense que, malgré leur soif, les malades n'osent plus boire. Le spasme devient rapidement un réflexe conditionné qui se déclenche à la vue d'un simple verre d'eau. |
 |
Moins caractéristiques sont les troubles végétatifs qui peuvent apparaître secondairement : sueur, hypersécrétion des larmes et hypersalivation (le malade « écume de rage » ).
2° - la forme furieuse (ou psychiatrique)
Il s'agit d'une variante violente et dramatique de la forme spastique : l'hyperexcitabilité du malade se traduit par une agressivité, des réactions violentes vis-à-vis de l'entourage. L'évolution de la forme furieuse vers le coma et la mort est rapide.
3° - la forme paralytique (ou tranquille)
Elle est plus rare et de diagnostic beaucoup plus difficile.
La rage paralytique est une paralysie ascendante ressemblant au syndrome de Landry-Guillain-Barré : paralysie des membres inférieurs, puis troubles sphinctériens et enfin atteinte bulbaire, responsable d'un arrêt cardio-respiratoire.
QUE FAIRE DEVANT UNE MORSURE...
| Les soins locaux sont essentiels |
Le traitement après exposition au risque rabique doit être entrepris sans délai. Devant toute morsure ou griffure, il faut – en urgence – désinfecter les plaies, l'élimination mécanique et chimique du virus étant la protection la plus efficace :

- on lave à grande eau la région mordue avec du savon ou un détergent (qui sont des virucides) puis on rince abondamment.
- on applique ensuite de l'alcool à 60°, de la Bétadine ® ou de l'eau de Javel diluée (éviter l'eau oxygénée et le mercurochrome).
- on ne suture pas la plaie mais on pense à la prévention du tétanos ! (un rappel de vaccin).
- une antibiothérapie est prescrite pour éviter l'infection de la blessure par d'autres agents pathogènes pouvant être transmis par l'animal (Pasteurella, notamment).
| La personne exposée est ensuite adressée à un centre antirabique qui seul peut apprécier le risque de contamination et décidera la mise en œuvre de la vaccination post-exposition. |
Faut-il un traitement antirabique ? ![]() la réponse dépend de l'animal mordeur !
la réponse dépend de l'animal mordeur !
1° - l'animal est vivant et récupéré
- le propriétaire de l'animal est connu
que l'animal soit vacciné ou non, le propriétaire doit le soumettre à 3 visites vétérinaires : J0 - J8 - J15
|
Pourquoi trois visites ? Dans le cas de la rage du chien, la durée de l'incubation, totalement silencieuse, est très variable : de 3 semaines à trois mois (des cas de plus de deux ans ont été signalés). |
- l'animal court encore...
il faut prévenir le commissariat de police, la gendarmerie, les pompiers ou la mairie. Si l'animal est récupéré, il sera mis en observation comme ci-dessus.
- si l'animal meurt au cours de la période d'observation :
on commence un traitement antirabique complet.
2° - l'animal a été abattu
contacter la mairie qui appelle les services vétérinaires départementaux. La tête de l'animal est expédiée par ces services dans un conteneur réfrigéré à un laboratoire spécialisé
![]() on commence le traitement antirabique
on commence le traitement antirabique
Selon les résultats du laboratoire, le traitement sera interrompu ou poursuivi.
3° - l'animal a disparu :
![]() on fait un traitement antirabique complet
on fait un traitement antirabique complet
En France, en 2002, les 55 centres antirabiques ont enregistré :
- 8 301 consultations :
- 4041 consultants ont été traités,
- 90 % suite à la morsure d'un animal domestique
(le chien dans 73 % des cas et le chat dans 20 %),
- 85 % des traitements ont été institués à la suite d'une contamination par un animal disparu.
Il s'agit d'un traitement post exposition : la longue incubation de la maladie permet au vaccin d'assurer une immunité protectrice avant que le virus infectant n'atteigne le système nerveux central.
La première vaccination, avec un vaccin élaboré sur tissu nerveux (moelle de lapin rabique, desséchée à l’air libre), a été tentée en 1885 par Louis Pasteur sur le jeune Joseph Meister et a donné au savant français une aura internationale. Le principal progrès notable depuis cette date est l’amélioration de la tolérance des vaccins.

Le vaccin "traitement"
Dans les pays développés, les vaccins antirabiques sont fabriqués à partir de souches de virus de génotype 1 (souches de la rage classique, donc éloignées des virus européens de chauves-souris appartenant aux génotypes 5 et 6), et sont produits, soit sur cellules de lignée continue Vero, soit sur cellules purifiées d’embryon de poulet, soit sur cellule diploïde humaine. Tous sont inactivés.
La tolérance tant des vaccins que des immunoglobulines est excellente.
Protocole classique de l'OMS
5 injections IM (dans le deltoïde) d'une dose de vaccin :
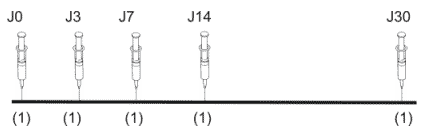
Protocole réduit de l'Institut Pasteur (dit "2-1-1")
4 injections IM (dans le deltoïde) - le premier jour, on injecte 2 doses en 2 points différents :
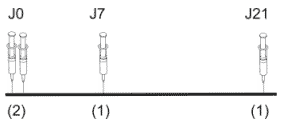
on observe un pic d'anticorps au 14° jour, plus précoce qu'avec le schéma de l'OMS (pic au 30° jour).
La séroprévention
les immunoglobulines réduisent les échecs de la vaccination en cas de contamination grave : une sérothérapie locale (au niveau de la morsure) et générale précède la vaccination, qui doit être faite selon le protocole classique de l'OMS. On utilise des immunoglobulines antirabiques d'origine équine ou d'origine humaine (Imogam Rage ® Mérieux).
Le vaccin "préventif"
- indications
- les voyageurs pour l'Afrique, l'Asie, l'Amérique du Sud (particulièrement les jeunes enfants dès l’âge de la marche).
- les personnes exposées au risque : personnel de laboratoire travaillant sur le virus, vétérinaires, personnel des abattoirs, équarrisseurs, personnel des fourrières, naturalistes, taxidermistes, gardes-chasse, gardes forestiers, chéroptérologues (aucun cas de rage humaine due aux virus des chauves-souris n’a été rapporté chez les personnes régulièrement exposées, mais correctement vaccinées de façon préventive et ayant reçu un traitement post-exposition conforme au protocole en vigueur validé).
- modalités
le vaccin est identique au vaccin traitement, mais la concentration antigénique est moins élevée (1,5 UI contre 2,5 UI) :
- 2 injections (IM ou SC) à un mois d'intervalle,
- 1 rappel après un an,
- puis un rappel tous les trois ans.
![]() on peut contrôler le taux des anticorps pour vérifier la protection.
on peut contrôler le taux des anticorps pour vérifier la protection.
Une telle vaccination ne supprime pas l'obligation d'un traitement à la suite d'une contamination, mais elle réduit l'importance du traitement : injection de 2 doses de vaccin à 3 jours d'intervalle.
LES EXAMENS DE LABORATOIRE
Le diagnostic clinique de la rage (animale ou humaine) n'est jamais un diagnostic de certitude. Le seul diagnostic indiscutable est le diagnostic biologique effectué au laboratoire. Ce diagnostic est du rôle exclusif du CNR, qu’il faut toujours contacter en cas de suspicion afin de réaliser les prélèvements adéquats et les acheminer dans des conditions optimales, dans le respect des règles de sécurité qu’impose la législation en vigueur.
En France, les deux structures officielles habilitées par les ministères de l'Agriculture et de la Santé à effectuer le diagnostic biologique de le rage sont l’Institut Pasteur de Paris, pour tout cas humain suspecté et pour tout animal susceptible d’avoir transmis la rage à un homme (voir coordonnées en fin de texte) et le Centre National d'études sur la rage de Nancy (laboratoire de référence de la rage animale, hors contact avec l’homme).
Toutes les manipulations concernant les prélèvements suspects doivent être effectuées dans des conditions de confinement de laboratoire de type P3.
Les prélèvements
les prélèvements animaux
Ce sont les plus fréquents.
Après accord téléphonique du destinataire, les prélèvements sont acheminés sous réfrigération (4°C) dans un triple emballage étanche.
|
Selon l'espèce animale incriminée, on envoie au laboratoire :
|
 |
les prélèvements humains
- du vivant d'un malade :
Le diagnostic biologique - parfois demandé dans les cas de suspicion clinique de rage humaine - est difficile, car les divers tests ne sont pas toujours positifs. Le diagnostic de certitude ne peut reposer que sur un faisceau de preuves.
- la recherche de virus et d'antigènes rabiques : prélèvement de salive (par aspiration), biopsies cutanées (terminaisons nerveuses des follicules pileux – menton, nuque), appositions cornéennes par attouchement du globe oculaire avec une lame de microscope, LCR (le LCR n’a qu’un intérêt réduit dans les prélèvements utiles au diagnostic, loin derrière la salive et la biopsie des follicules pileux).
- la recherche et le dosage des anticorps : sang total, LCR.
- après la mort :
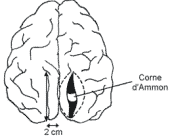
- · envoi du cortex cérébral, de l'hippocampe, glandes salivaires, œil.
Les techniques
Plusieurs techniques sont employées pour le diagnostic :
1° – identifier les antigène rabiques dans les cellules
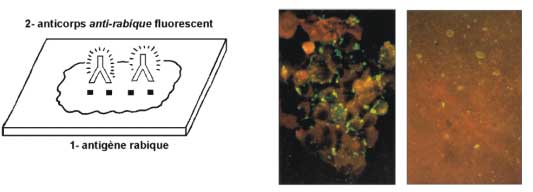
. par immunofluorescence directe
Sur des impressions de corne d'Ammon, de bulbe et de cortex.
Technique de référence, elle peut conduire à un diagnostic certain en quelques heures, sur du matériel frais ou bien conservé.
Le test est basé sur la reconnaissance de l'antigène rabique par un anticorps spécifique couplé à la fluorescéine ‚ : les anticorps fluorescents se fixeront seulement sur l'antigène, révélant celui-ci lors de la lecture de la lame à l'aide d'un microscope fluorescent.
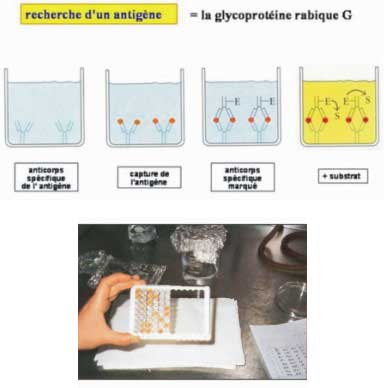
. par une méthode ELISA (technique sandwich)
On réalise une immunocapture des antigènes rabiques.
- Les puits d'une plaque de microtitration sont tapissés par les anticorps d'un sérum de lapin immunisé contre les antigènes de la nucléocapside.
- Le surnageant du broyat de tissu est déposé dans les puits. L'antigène, s'il est présent, est capturé par l'anticorps.
- Après lavage, on ajoute les anticorps antirabiques couplés à la peroxydase.
- Le substrat ajouté subit l'action de l'enzyme : l'apparition d'une couleur jaune, signe la présence de l'antigène rabique dans le tissu testé.
Le test est simple, rapide (quelques heures), sensible et spécifique.
2° – isolement du virus
- L'isolement du virus sur culture cellulaire (cellules en lignées continues de neuroblastome de la souris) est un test très sensible et permet de porter un diagnostic rapide (moins de 24 heures) si le prélèvement a été correctement réalisé.
L'isolement confirme la détection des antigènes viraux et permet de déterminer le sérotype de la souche isolée à l'aide d'anticorps monoclonaux.
On recherche les antigènes viraux dans les cellules inoculées, par les tests d'immunofluorescence directe ou d'immuno-enzymologie décrits ci-dessus. - La technique est plus rapide, plus fiable et moins dangereuse que l'inoculation à la souris

3° – détection de l'ARN viral
À partir de la salive ou du LCR, le génome viral peut être détecté par amplification génique : RT-PCR (rétrotranscription de l’ARN viral en ADN amplifié par polymérisation en chaîne (Polymerase chain reaction).
4° –génotypage du virus
Après l'amplification par RT-PCR on procède au séquençage du gène de la nucléoprotéine N et de la glycoprotéine G.
5° – dosage des anticorps
Le titrage des anticorps permet de vérifier et d'évaluer le degré d'immunité des sujets contre la rage, avant ou après exposition au risque de contamination (seuil immunisant : > 0,5 UI par ml).
On utilise une technique immunoenzymatique de type ELISA.
La détection des anticorps antirabiques dans le sang n'a qu'un intérêt très limité dans le diagnostic de la rage car ils n'apparaissent que tardivement.
|
A RETENIR Bien que l'observation d'une rage humaine en France soit rare (mais reste un événement dramatique porteur d'une très forte charge émotionnelle), il faut garder à l’esprit que la rage est une maladie toujours mortelle est qu’elle est encore classée parmi les grandes causes de décès dans de nombreux pays du monde, alors qu'il est possible de la prévenir par une vaccination efficace et bien tolérée grâce au vaccin sur cultures cellulaires. |
Ce cours a été préparé par le Pr Anne Decoster, le Dr Jean-Claude Lemahieu (Faculté Libre de médecine de Lille), et le Pr Hélène Peigue-Lafeuille (Faculté de médecine de Clermont Ferrand)
Pour en savoir plus :
BEH 2005 n°24-25 « Santé des voyageurs et recommandations sanitaires » et n° 29-30 « Calendrier vaccinal 2005 »
« La rage : état des lieux en 2004 et persistance des risques en France » SPECTRA BIOLOGIE, par Hélène PEIGUE-LAFEUILLE et Hervé BOURHY, n°143 – Janvier Février 2005
« La rage humaine en France en 2004 : état des lieux et prise en charge » par H. PEIGUE-LAFEUILLE et al., Médecine et maladies Infectieuses 34 (2004) 551-560 accessible sur www.sciencedirect.com
Traité de Virologie Médicale, par JM HURAUX, H PEIGUE-LAFEUILLE, JC NICOLAS, H AGUT, 2003, éd. ESTEM-AUF
Site de l’OMS www.who.int/en/
Site de l’Organisation Mondiale de la Santé Animale www.oie.int/
Site de l’Institut de Veille Sanitaire www.invs.sante.fr
Site de l’Agence Française de Sécurité sanitaire des Aliments www.afssa.fr (publications puis éditions)
Site du ministère de l’agriculture www.agriculture.gouv.fr
Site de l’Union nationale des centres de soins pour la faune sauvage www.chez.com/uncs
Site du ministère de la santé www.sante.gouv
Site de la société Française pour l’étude et la protection des mammifères www.sfepm.org
Coordonnées du CNR rage : CNR rage, Unité de Virologie, Institut Pasteur, 25-28, rue du Dr Roux, 75724, Paris Cedex 15
Téléphone : 0145 68 87 85
Site : http://www.pasteur.fr/sante/clre/cadrecnr/rage-index.html
« Virologie médicale » A. Mammette, Collection AZAY, Presses Universitaires de Lyon. 2002, 80 Boulevard de la Croix Rousse, BP 4371, 69242 LYON 04
|
|
|
|
|
