

| - Connaître les principaux syndromes provoqués par les Leptospira - Connaître les principaux réservoirs de germes et les modes de contamination - Connaître les principaux critères de diagnostic biologique de la maladie humaine. - Connaître les antibiotiques actifs et les principes généraux de leur utilisation. |
1 - Introduction
Plus de 230 sérovars, regroupés en 23 sérogroupes, ont été impliqués en pathologie humaine, et 7 espèces pathogènes sont associées à la maladie humaine et animale.
2 - Historique
Weil et Mathieu décrivent, en 1886, l'essentiel du tableau clinique. En 1915, Inada et Ido isolent Spirochaeta icterohaemorrhagiae, et montrent que le rat en est l'hôte privilégié. La guerre de 1914-18 fait émerger en France cette spirochétose, confondue au départ avec la fièvre des tranchées (à Bartonella quintana).
 |
En 1916, Uhlenhuth et en 1917, Martin et Pettit (1917) isolent les premières souches. En 1918, Martin et Pettit démontrent la présence d’anticorps agglutinants dans le sérum des malades et décrivent la réaction d'agglutination lyse, toujours méthode de référence pour le diagnostic sérologique de la maladie. Photo du Dr. Louis Martin |
3 - Ecologie - Pouvoir pathogène
Réservoir animal
|
* Diversité extrême des espèces animales réservoirs : |
 |
* Expression clinique extrêmement variable selon l’espèce animale : infections chroniques beaucoup plus fréquentes que les infections aiguës ou subaiguës :
- Formes aiguës : septicémies, hépatites, néphrites et hémoglobinuries (formes ictéro-hémorragiques des primates non humains et des canidés).
- Formes subaiguës : signes généraux discrets, avortements fréquents (bovins, porcins).
- Formes chroniques : avortements, néphrites interstitielles, infertilité, uvéites (chevaux).
* Animaux porteurs contaminent leurs congénères par transmission directe (passage transplacentaire, rapports sexuels, allaitement) et les autres espèces animales par transmission indirecte (milieu extérieur souillé par l'urine des animaux infectés). Le portage rénal est asymptomatique chez les rongeurs et les micro-mammifères terrestres, assurant la contamination continue de leur environnement.
Survie dans l’environnement
Pas de multiplication dans le milieu extérieur. Survie jusqu’à 6 mois dans l'eau, les sols boueux à pH légèrement alcalin, d'une salinité très faible et en l'absence de rayonnements ultraviolets.
Modes de transmission à l’homme
Pénétration par les muqueuses intactes (conjonctives, muqueuse naso-pharyngée, poumons en cas d’inhalation d’eau) et par des plaies ou excoriations cutanées.
* Contact direct
Avec le germe (personnel de laboratoire), ou avec des animaux infectés ou leurs organes (éleveurs, vétérinaires, employés d'abattoir, bouchers, employés de tanneries...)
| * Contact indirect (le plus fréquent) - Travail en environnement contaminé par l'urine d’animaux infectés (égoutiers, agents de voirie, éboueurs, dératiseurs, agents de stations d'épuration, d'entreprises de travaux publics, agriculteurs travaillant en terrain humide ou en rizières, forestiers, ...). - Pratique de loisirs aquatiques (baignades, planche à voile, canoë-kayak), de la chasse et de la pêche en eau douce. - Situation de catastrophe naturelle (inondations, cyclones), par contact prolongé avec les eaux de surface et proximité hommes / micro mammifères. - Transmission interhumaine exceptionnelle (urinaire, sexuelle, transplacentaire, allaitement). |
 |
4 - Epidémiologie
Mondiale
Répartition hétérogène des espèces pathogènes.
Quelques sérovars ubiquistes : icterohaemorrhagiae, canicola, pomona, hardjo.
La majorité des sérovars de l’espèce L. interrogans est isolée d’Asie, comme la totalité de ceux de L. weilii et L. alexanderi. L. borgpetersenii est endémique en Europe et Asie, L. kirschneri en Afrique et Europe, L. santarosai en Amérique du sud et centrale et L. noguchii en Amérique du Nord et Centrale.
La leptospirose est une maladie endémique de la zone intertropicale. Son incidence est maximale en Asie (rizières), où elle peut atteindre 3% par an (Vietnam), est élevée dans le Pacifique, l’Australie, l’Océan Indien (sauf Madagascar) l’Amérique Centrale et du Sud. En Afrique, son incidence reste mal connue. En Europe elle est modeste (sauf en France et en Grande Bretagne) et elle est rare aux USA (incidence 30 fois inférieure à celle de la France). Des données nationales de plusieurs pays ont été colligées en 1999 (WER, 1999)(http://www.who.int/wer/pdf/1999/wer7429.pdf).
France Métropolitaine
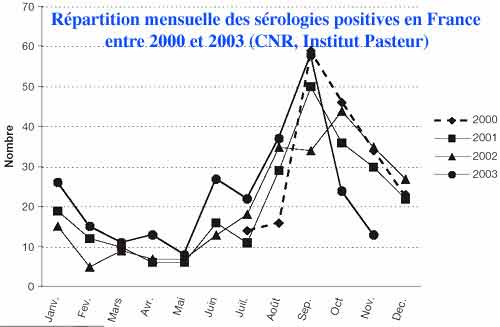
L’incidence varie selon les régions : inférieure à 0,1/100000 hab dans le Sud Est, les zones montagneuses, la Picardie, la Bretagne et la Haute Normandie elle peut dépasser 1/100000 hab en Franche Comté, Ardennes, Aquitaine et Sud Ouest en général. La moyenne nationale (DOM-TOM exclus) est de 0,5/100000. Principaux sérogroupes : Icterohaemorrhagiae, Grippotyphosa, Australis, Hebdomadis et Sejroe.
La canicule de 2003 a été sans augmentation notable
http://www.invs.sante.fr/recherche/index2.asp?txtQuery=leptospirose
Outre-Mer
Aux Antilles-Guyane, l’incidence est 20 fois plus élevée qu‘en Métropole, 40 fois plus à la Réunion, 80 fois en Polynésie et 100 à 200 fois en Nouvelle Calédonie qui associe climat tropical et pratique de l’élevage. Icterohaemorrhagiae est prédominant dans les DOM-TOM.
5 - Maladie humaine - Caractéristiques cliniques :
Si la maladie de Weil, première forme décrite, est bien individualisée, elle est peu fréquente (moins de 10% des cas). La caractéristique clinique de la leptospirose est de ne pas en avoir.
Plusieurs formes sont néanmoins individualisées :
- Formes bénignes anictériques, pseudo grippales représentent 80 % des cas : syndrome infectieux isolé, d’intensité variable (suffusions conjonctivales, myalgies surales) durant 3-7 jours, brève rémission (1-3 jours), puis phase d’état (4-30 jours) associant fièvre modérée, asthénie marquée et pléiocytose du liquide céphalo-rachidien. A tout moment, ces formes peuvent évoluer vers une forme sévère avec atteinte viscérale isolée (foie, reins) ou défaillance polyviscérale.
- Maladie de Weil ou forme ictéro-hémorragique, qui est biphasique: tableau septicémique initial (fièvre élevée, céphalées, prostration, troubles de la conscience,...), défervescence vers le 5ème jour, puis deuxième phase (apparition des anticorps vers le 10ème jour) avec insuffisance rénale, hémorragies diffuses, atteinte hépatique (ictère flamboyant), rash cutané, signes méningés et myocardiques. L'ictère disparaît entre le 15ème et le 25ème jour avec la survenue d'une remontée thermique. Taux de mortalité: 15 - 40 % selon les moyens de réanimation disponibles.
- Formes pulmonaires ou " pulmonary haemorrhagic fever ", avec un tableau d’hémoptysies et de dyspnées sévères, dans un contexte de pneumopathie interstitielle diffuse similaire aux formes pulmonaires des infections à Hantavirus.
- Formes cardiaques: myocardite hémorragique, troubles du rythme.
- Formes neurologiques: syndrome méningé fébrile, se compliquant d'encéphalite dans 25% des cas
6 - Physiopathogénie
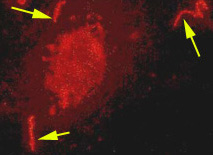
| La première phase de l'infection est liée au passage transcutané ou transmuqueux dont le processus reste inconnu. Les leptospires peuvent traverser la peau saine et leur mobilité contribue à leur diffusion dans l'organisme hôte. Il n’y a pas d'afflux de cellules inflammatoires au point d'entrée. Leur multiplication s’effectue dans le sang et dans les organes cibles, avec un temps de génération de 8 heures environ. (Photo: Cellules VERO avec leptospires révélès par immunofluorescence). La réponse immunitaire humorale est détectée dès le huitième jour chez l'homme. Ces anticorps sont opsonisants et mettent en jeu la phagocytose par les macrophages et les polynucléaires. Les leptospires peuvent aussi être lysés par le système anticorps/complément. |
 |
|
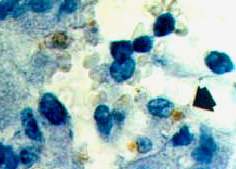
L’induction d’une apoptose des macrophages a été démontrée in vitro. Le foie semble jouer un rôle fondamental dans la phase initiale de la maladie puisque, in vivo, les leptospires y induisent une apoptose des hépatocytes à même de favoriser leur multiplication (Photo: les noyaux bruns représentent les hépatocytes aptoptotiques à chromatine condensée). La colonisation des autres organes cibles (cœur, reins, méninges, etc) semble s’effectuer via un second passage dans la circulation générale. Enfin, des capacités invasives des leptospires pour les cellules eucaryotes, via l'endocytose médiée par récepteur, ont été montrées in vitro. |
 |
7 - Diagnostic biologique
Le diagnostic est difficile en début de maladie, vu le polymorphisme clinique.
En zone tempérée, c’est le contexte épidémiologique et le bilan biologique non spécifique (NFS, bilan inflammatoire) qui seront déterminants pour exclure l’hypothèse virale.
En zone tropicale, les diagnostics différentiels d’une arbovirose (dengue ++) et du paludisme sont au premier plan.
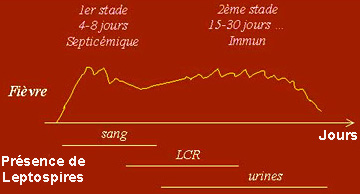 |
Il s'agit d'une recherche particulière, d'où une demande précise auprès du biologiste selon la chronologie suivante: culture et/ou amplification génique (PCR) dès la prise en charge du patient puis sérologie (à partir du 8 ème jour pour le premier test). Ces trois approches sont complémentaires pour le diagnostic biologique de la leptospirose. |
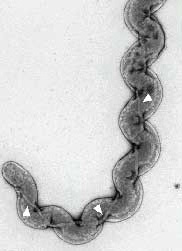
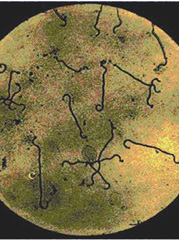
- L'examen direct au microscope à fond noir est à proscrire à cause des faux positifs (débris cellulaires, fibrine).
- La culture s'effectue sur des milieux particuliers (tween-albumine EMJH, liquide ou partiellement gélosé) à 30°C à l'obscurité durant 2 mois. L'agitation des cultures facilite la croissance (métabolisme aérobie). Un examen hebdomadaire est effectué au microscope à fond noir
Attention aux risques de contaminations humaines (entre les classes biologiques 2 & 3).
| Morphologie: bactéries finement spiralées, flexibles, mobiles et aux extrémités en crochets visualisées au microscope à fond noir. Diamètre cellulaire: 0,1 mm ; longueur : 6 à 12 mm. Les caractères morphologiques, la mobilité et la croissance en EMJH (seul spirochète poussant sur ce milieu) affirment l'appartenance au genre Leptospira. La première étape de détermination de l'espèce différencie les souches pathogènes des saprophytes (Croissance à 13°C et en présence de 8-azaguanine). L’identification précise de l’espèce, du sérogroupe et du sérovar a un intérêt épidémiologique fondamental. Il relève d’un laboratoire de référence (CNR ou CCOMS) avec des méthodes sérologiques complexes et/ou moléculaires (sondes, électrophorèse en champ pulsé). |
 |
 |

 |
- Diagnostic sérologique Celui-ci est réservé à quelques laboratoires avec la mise en oeuvre de plusieurs techniques (ci-dessous). Celui-ci se positive vers le 8-10ème jour après le début de la maladie. Les anticorps décroissent sur 3 à 6 mois, peuvent persister à des taux résiduels plusieurs années. La cinétique des anticorps est indispensable (2 tests à 2 semaines d’intervalle) et son interprétation intègre les données chronologiques et cliniques. 1 - ELISA: Antigène non purifié (formaldéhyde et chauffage) de la souche saprophyte Patoc. Anti IgM humain couplé à la peroxydase. Titre seuil : 1/400. Anticorps sériques détectables à partir du 8ème jour suivant l'apparition de la fièvre. Sensible et spécifique, excepté pour les sérogroupes Grippotyphosa ou Australis, ce qui la limite à une réaction de dépistage. |
Evaluation au microscope à fond noir du degré d'agglutination de cultures de leptospires par le sérum du malade. Réaction de référence qui nécessite une batterie d'antigènes: souches représentatives des principaux sérogroupes (20-23 antigènes). Technique complexe réservée à un laboratoire de référence. Titre seuil: 1/100.
- Diagnostic moléculaire (PCR)
Il peut être positif dès le second jour de la maladie puis jusqu’au 12ème jour. La recherche s'effectue à partir du sérum, LCR, urines, humeur aqueuse.


Les limites sont les faux négatifs (inhibiteurs, charge bactérienne faible). Sa contribution est déterminante pour une évaluation fiable du niveau réel de l'endémie dans une zone géographique donnée.
L'amplification couplée à l'hybridation par une sonde complémentaire donne une sensibilité accrue. La séquence cible (331 pb du gène codant pour l'ARN ribosomal 16S) est spécifique du genre Leptospira, donc commune à toutes les souches de leptospires.
8 - Sensibilité aux antibiotiques
- Ces bactéries sont sensibles à la quasi totalité des antibiotiques. In vitro, l'ampicilline et le céfotaxime ont les CMI et CMB les plus basses. Chez le hamster infecté expérimentalement, la doxycycline assure une élimination complète des leptospires, y compris au niveau rénal.
Chez l'homme, l'efficacité a été démontrée par des études randomisées vis-à-vis de la doxycycline et de la pénicilline G. Ainsi le traitement des formes sévères s'appuiera sur la pénicilline G (6 millions d'UI par 24 heures par voie IV sur une semaine, prolongé selon l'évolution clinique). L' ampicilline per os (2 g/j) est indiquée dans les formes mineures et au début de l'expression clinique de la maladie.
Chez l'animal, la streptomycine est la plus utilisée.
9 - Prophylaxie
Prophylaxie animale
Il existe des vaccins inactivés destinés aux bovins (hardjo), porcs (pomona) et chiens (canicola, icterohaemorrhagiae). Efficacité non démontrée sur le portage urinaire et les troubles de la reproduction.
| Prophylaxie humaine: protection collective et individuelle - Mesures de luttes collectives : dératisation, contrôle des effluents des élevages industriels, drainage des zones inondées. Efficacité certaine, mais mise en œuvre difficile. - Mesures individuelles : port de tenues de travail adaptées (bottes, gants) pour les professionnels exposés. - Antibioprophylaxie efficace (doxycycline 200 mg hebdomadaire) pour des expositions importantes sur de courtes périodes (militaires) - Vaccin humain inactivé anti-Icterohaemorrhagiae proposé en France aux travailleurs très exposés (égoutiers, éboueurs); induction d’anticorps agglutinants au pouvoir protecteur non quantifié. |
  |
Ce cours a été préparé par le Dr. P. PEROLAT (Ancien Chef de Laboratoire à l'Institut Pasteur de Paris))(20.05 2003).
Pour en savoir plus :

Quelques adresses:
http://www.sante.gouv.fr/htm/actu/31_030822.htm
http://www.invs.sante.fr/publications/2004/leptospirose/
http://www.pasteur.fr/recherche/Leptospira/LeptospiraF.html
http://www.invs.sante.fr/beh/2002/35/index.htm
http://www.invs.sante.fr/publications/2003/leptospirose/rapport_leptospirose.pdf
http://www.med.monash.edu.au/microbiology/staff/adler/ilspage.htm
http://www.who.int/wer/pdf/1999/wer7429.pdf
http://www.nephrohus.org/uz/article.php3?id_article=128
|
|
|
|
|