1. GÉNÉRALITÉS SUR LES HERPÈSVIRIDÆ (VIRUS HERPÉTIQUES)
2. LES VIRUS DE L'HERPÈS OU HERPÈS SIMPLEX VIRUS (HSV-1 et 2)
2-1. "Les" virus de l'herpès
2-2. Manifestations habituelles des infections à HSV-1
2-3. L'herpès simplex virus type 2 (HSV-2)
2-4. Quatre infections graves à Herpès Simplex Virus – 1/2
2-5. Diagnostic au laboratoire de virologie des infections à HSV-1 et HSV-2
2-6. Traitement
2-7. Rappel des points importants
3. LES VIRUS DE LA VARICELLE ET DU ZONA (VZV)
3-1. La varicelle
3-2. Le zona
3-3. La transmission de l'infection à virus VZ
3-4. Le diagnostic
3-5. Le traitement des infections à VZV
3-6. Rappel des points importants
4. LE CYTOMÉGALOVIRUS (CMV)
4-1. Le virus et sa multiplication
4-2. L'épidémiologie de l'infection à CMV
4-3. La physiopathologie de l'infection à CMV
4-4. Les manifestations cliniques de l'infection à CMV
4-5. Le diagnostic de l'infection à CMV au laboratoire de virologie
4-6. Traitement
5. LE VIRUS EPSTEIN-BARR (EBV)
5-1. Le virus
5-2. La physiopathologie
5-3. L'épidémiologie de l'infection à EBV
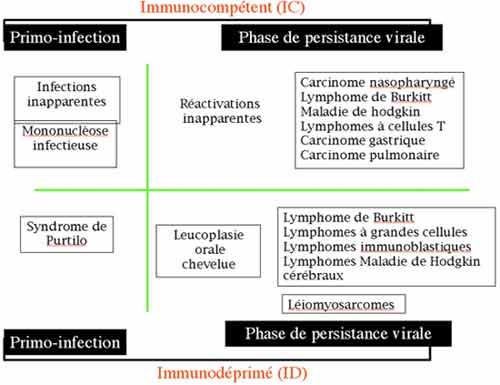
5-4. L'infection à EBV chez les sujets immunocompétents
5-5. L'infection à EBV chez les immunodéprimés
5-6. Le diagnostic virologique des infections à EBV
5-7. Rappel des points importants
6. LE 6ème HERPESVIRUS HUMAIN (HHV-6)
7. LE 8ème HERPÈSVIRUS HUMAIN (HHV-8)
1. GÉNÉRALITÉS SUR LES HERPESVIRIDÆ (VIRUS HERPÈTIQUES)
La famille des herpesviridæ est constituée d'une centaine de virus dont 8 strictement humains.
- Le virus de l'herpès, ou herpes simplex virus (HSV), de type 1 ou de type 2 (HSV-1 ; HSV-2).
- Le virus de la varicelle et du zona ou herpesvirus varicellæ (VZV)
- Le cytomégalovirus (CMV)
- Le virus EPSTEIN-BARR ou virus E-B (EBV)
- Les 6ème, 7ème et 8ème herpesvirus humains (HHV-6, HHV-7 et HHV-8)
Ces virus ont en commun certains caractères. Ce sont des virus à DNA de poids moléculaire élevé (150 à 230.000 paires de bases), codant donc un grand nombre de protéines (une centaine).
Ils ont une capside icosaédrique faite sur le même modèle (162 capsomères, à titre indicatif).
Ils ont un péplos ou enveloppe, dérivé de la membrane nucléaire.
En effet, l'encapsidation du DNA viral à l'intérieur de la capside se fait dans le noyau puis le virus quitte le noyau par bourgeonnement, bourgeonnement de la membrane nucléaire modifiée par l'adjonction de glycoprotéines virales. L'ECP des herpesviridæ, quand il existe (HSV, VZV, CMV), consiste donc en modification du noyau.
La réplication du DNA viral, très différent du DNA cellulaire, ne peut être assurée par les enzymes cellulaires : elle exige une DNA polymérase virale, cible des antiviraux actuellement disponibles. Les HSV et le VZV ont de plus une thymidine kinase virale, le CMV et l'HHV-6 une phosphotransférase qui phosphorylent les nucléosides naturels ou les nucléosides synthétiques antiviraux.
Enfin le péplos est très fragile. D'où une transmission inter-humaine directe nécessitant des contacts étroits, intimes.
Certains de ces virus ont un pouvoir cancérigène, dans des conditions particulières.
Du point de vue étymologique, herpès vient du grec et implique l'idée de ramper comme un serpent. De fait, après primo-infection, ces virus herpétiques restent tapis dans l'organisme sous forme "dormante" réalisant une "infection latente" qui les soustrait au système immunitaire comme aux antiviraux (camouflage). Ainsi, ces virus qu'on ne peut éradiquer deviennent après la primo-infection des constituants de notre organisme. C'est une façon de pallier leur fragilité dans le milieu extérieur. L'infection latente peut se réactiver, donnant alors une réinfection endogène, ce qu'on appelle une récurrence.
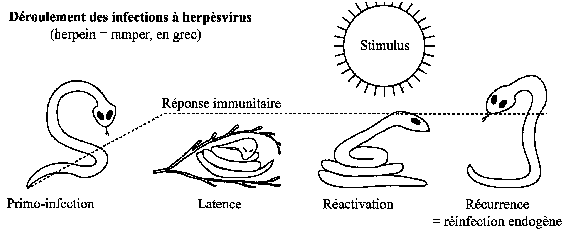
Les récurrences sont l'occasion d'une excrétion virale, souvent asymptomatique, assurant l'infection de nouveaux hôtes. Quant au siège de l'infection latente, pour les HSV-1 et 2 et le VZV "dermoneurotropes", il s'agit du ou de ganglion(s) sensitif(s) du territoire de la primoinfection. Pour les autres herpesviridæ humains qualifiables de leucotropes, il s'agit des cellules immunes.
Ces gros virus à grand génome, riches en protéines immunogènes, seraient des cibles faciles pour nos défenses antivirales, s'ils ne consacraient nombre de leurs gènes à contrer nos défenses. Soit passivement par camouflage grâce aux gènes de latence. Soit activement par sabotage de la présentation des antigènes par le CMH, de la lyse des cellules infectées par les CTL, de l'action des Interférons …etc, cela par des leurres = homologues de protéines cellulaires modifiées produites grâce à des gènes pris aux cellules par piraterie génique.
Ainsi au cours d'une co-évolution sur des millions d'années, homme et herpesviridae ont trouvé un modus vivendi leur évitant la destruction mutuelle. Il est cependant remis en question en cas d'immunodépression, qui majore les manisfestations cliniques de l'infection par herpesviridae.
2. LES VIRUS DE L'HERPÈS, OU HERPES SIMPLEX VIRUS
Les herpès simplex virus type 1 et type 2 (HSV-1, HSV-2) sont des virus dermo-neurotropes donnant après la primoinfection une infection latente dans le ganglion sensitif du territoire de la primoinfection. C'est le ganglion de Gasser après primoinfection orale par HSV-1, les ganglions sacrés après primoinfection génitale par HSV-2. (figure 2) Cela assure la persistance du virus dans la population. A partir de ces sites d'infection latente peuvent survenir des réactivations conduisant à des poussées d'herpès récurrent (ou récidivant) ou à des excrétions asymptomatiques de virus dans la salive ou les sécrétions génitales. Cela assure la dissémination de l’infection aux sujets réceptifs. A côté des manifestations cutanéo-muqueuses banales, localisées, de l'herpès oral et de l'herpès génital, on observe dans certaines conditions des infections mortelles où l'usage de l'Aciclovir a un intérêt vital.
2-1. "Les" virus de l'herpès, car il existe l'herpes simplex virus de type 1 (HSV-1) et l'herpes simplex virus de Type 2 (HSV-2)
Ces virus ont un tropisme pour la peau, les muqueuses, et le système nerveux. L'HSV-1 et l'HSV-2 se partagent le corps : l’HSV-1 responsable de l'herpès oral, règne au-dessus de la ceinture, avec infection latente du ganglion de Gasser, l’HSV-2 responsable de l'herpès génital, avec infection latente des ganglions sacrés. Cependant les contacts oro-génitaux peuvent remettre en question ce partage du territoire. Il existe une immunité croisée mais partielle seulement entre HSV-1 et HSV-2.
Ainsi une primo-infection orale et même des réinfections endogènes avec l'HSV1, n'empêchent pas de s'infecter ultérieurement avec l'HSV-2 au niveau génital.
Nous examinerons donc ce que donnent habituellement chez l'homme, la primo-infection et les réinfections endogènes par l'HSV-1, puis la primo-infection et les réinfections endogènes par l'HSV-2. Nous verrons ensuite quatre infections inhabituelles, graves, qui font intervenir tantôt l'HSV-1 et tantôt l'HSV-2.
2-2. Manifestations habituelles des infections à HSV-1
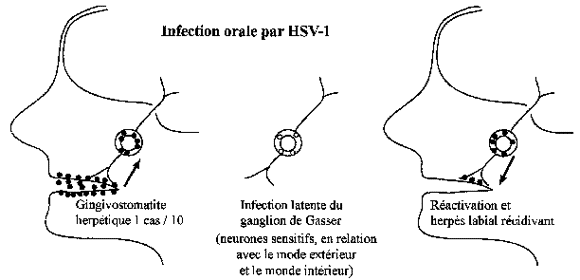
A. Primo-infection
C'est vers 6 mois à un an, après la perte des anticorps maternels, que la plupart des sujets s'infectent par HSV-1 à partir de l’excrétion salivaire d’un sujet de l’entourage. Des études sérologiques ont prouvé que le plus souvent cette PRIMO-INFECTION orale est inapparente. Ce n'est que chez 10 à 15 % des sujets qu'elle donne des manifestations cliniques : une gingivo-stomatite faite de vésicules multiples sur la muqueuse buccale et sur les lèvres.
Sur les muqueuses, les vésicules sont fragiles et elles s'ulcèrent rapidement. Ces ulcérations sont douloureuses et gênent considérablement l'alimentation, de sorte qu'on est parfois amené à nourrir ces jeunes enfants par perfusion intra-veineuse, ou par sonde nasopharyngée, le temps que les lésions guérissent. Il s'y associe habituellement de la fièvre et des adénopathies cervicales, parfois une virémie.
La gingivo-stomatite herpétique s'accompagne parfois d'un panaris herpétique des doigts ou des orteils, par autoinoculation (succion). Un panaris herpétique s'observe parfois chez les dentistes ; l'incision chirurgicale est contre-indiquée : il n'y a pas de pus.
Cette primo-infection suscite une réponse immunitaire locale et générale avec l'apparition d'anticorps dans le sang circulant (séroconversion) et dans les sécrétions buccales.
B. Récurrence
Après la guérison de cette primo-infection, le virus peut être excrété dans la salive de façon intermittente. Surtout il peut, chez un pourcentage notable de sujets, donner des RECURRENCES, dans le même territoire que la primo-infection. Ces récurrences se font malgré la présence d'anticorps. L'infection est plus limitée que durant la primo-infection : c'est un bouquet de vésicules à la jonction de la peau et de la muqueuse buccale, c'est-à-dire sur le bord des lèvres : c'est l'herpès labial récidivant. Il existe également des récurrences inapparentes cliniquement, se limitant à une excrétion salivaire asymptomatique d'HSV-1. Herpès labial récidivant et excrétion salivaire asymptomatique permettent la diffusion de l’infection aux individus plus jeunes et réceptifs.
C. Latence
Entre la primo-infection et la ou les récurrences, le virus reste LATENT dans l'organisme et l'on connaît le gîte de ce virus : c'est le corps cellulaire des neurones sensitifs périphériques innervant le territoire de la primo-infection.
Ces corps cellulaires forment un renflement, un ganglion sensitif sur la racine postérieure des nerfs. Pour la cavité orale, le nerf sensitif est le trijumeau dont la racine postérieure porte le ganglion de GASSER. Le virus y est latent, sous forme de DNA viral, sans particules virales visibles en microscopie électronique. [Si l'on prélève ce ganglion au cours d'une autopsie et si on le broie, le broyat inoculé à des cultures de cellules sensibles, (fibroblastes humains par exemple), ne donne pas de multiplication virale. Pour trouver le virus, il faut cultiver les cellules nerveuses du ganglion et les mélanger à des cellules fibroblastiques humaines (coculture). L'HSV-1 latent dans le ganglion de Gasser est très étroitement associé aux cellules nerveuses sous une forme mal connue].
Or, chez certains sujets, ce virus latent se met soudain à se multiplier dans le corps cellulaire des neurones sensitifs, (réactivation) et gagne par voie neuronale centrifuge, la jonction cutanéo-muqueuse, donnant là les vésicules caractéristiques de la récurrence d'herpès labial qui est une réinfection endogène. Le virus est présent dans les vésicules mais entre les récurrences, il n'est pas retrouvé dans la peau, ni dans les muqueuses. Entre les récurrences le virus n'existe que sous forme de génome dans le corps cellulaire du neurone sensitif périphérique.
Il est curieux que la réactivation de l'infection dans le ganglion de Gasser ne détruise pas le ganglion alors que le virus est très neurotrope.
Le terme virus de sortie souvent employé par les cliniciens est très approprié.
Qu'est-ce qui induit cette multiplication virale intermittente, cette réactivation ? Ce sont des stimuli divers qui, chez certains sujets, sont la fièvre, quelle qu'en soit la cause, mais plus particulièrement certaines infections bactériennes, comme la méningite cérébro-spinale, la pneumonie à pneumocoque, la leptospirose ictéro-hémorragique ; chez d'autres sujets c'est l'approche des règles ou l'exposition aux rayonnements ultraviolets, le séjour en montagne, les contrariétés pour l'herpès labial. Il arrive que ces récurrences soient très fréquentes, gênant considérablement le sujet.
[On connaît donc les stimuli des récurrences d'herpès labial, mais on ne sait par quel mécanisme ces stimuli si divers suscitent la réactivation - celle-ci survient malgré un titre d'anticorps circulant anti-HSV-1 relativement élevé, surtout chez les sujets qui ont eu plusieurs récurrences.
A défaut de connaître le mécanisme intime des récurrences d'herpès labial on peut seulement constater que la latence siège dans une cellule vraiment très particulière, en relation tant avec le monde extérieur et ses agressions physiques qu'avec le monde intérieur et ses affects. D'où le caractère psychosomatique de l'herpès labial récurrent].
Ainsi la plupart des sujets normaux ont de temps en temps de l'HSV-1 sur les lèvres, dans la salive et c'est essentiellement par la salive des personnes de leur entourage que les enfants très tôt s'infectent avec l'HSV-1.
2-3. L’Herpès Simplex Virus Type 2 (HSV-2)
L'HSV-2 est présent dans les sécrétions génitales et c'est surtout lors des premiers rapports sexuels que survient la primo-infection. La primo-infection est asymptomatique dans 2/3 des cas, manifeste dans l'autre tiers sous forme de vésicules sur le gland et le prépuce, ou sur la vulve et le vagin, voire le col utérin, donnant une vulvo-vaginite avec cervicite. Ce sont des vésicules ulcérées, douloureuses. Cette primo-infection à HSV-2 s'accompagne souvent de fièvre, d'adénopathies inguinales, parfois d'une rétention d'urine, et même de méningite à liquide clair. La fréquence de l'herpès génital augmente inévitablement avec le nombre de partenaires sexuels, comme pour toute M.S.T.
Les récurrences qui frappent certains sujets sont moins intenses que la primo-infection, mais cependant douloureuses. L'HSV-2 reste latent dans les ganglions sacrés. C'est de là que viennent les poussées d'herpès génital récidivant mais aussi une excrétion asymptomatique intermittente de virus rendant le sujet potentiellement contagieux, même en l'absence de lésions. On parle alors de "contamination asymptomatique ou innocente".
À noter que l'herpès génital récidivant facilite la contamination sexuelle par HIV, comme toute affection génitale ulcérative.
L'herpès génital de la petite fille peut être dû à un abus sexuel, mais aussi à une contamination par le linge de toilette d'un parent atteint d'herpès génital ou labial.
2-4. Quatre infections graves à HSV-1/2
A. L’herpès oculaire
Il peut s'agir simplement d'une conjonctivite, se traduisant par une congestion de la conjonctive oculaire et palpébrale. L'œil est rouge et le malade a une impression de douleur ou de "sable dans l'œil". Il arrive que l'infection dépasse la conjonctive pour toucher la cornée, ce qui donne alors une kératite. Une kératite avec ulcère dendritique (= dentelé en feuille de fougère) est pathognomonique de l'herpès oculaire. C'est une infection grave, car les lésions de la cornée peuvent laisser une cicatrice fibreuse opaque, appelée taie. Si elle se trouve en face de la pupille, elle rend aveugle. Cette taie peut se constituer lors d'une kératite de primo-infection ou plus souvent lors de récurrences. Il arrive que le passage de la conjonctivite à la kératite soit dû à l'application locale de corticoïdes. C'est une lourde erreur que de donner un collyre aux corticoïdes à un sujet qui a un œil rouge pour calmer la douleur, sans avoir auparavant éliminé une conjonctivite herpétique. On risque en effet une perforation de la cornée.
B. L’herpès néo-natal
L'incidence de l'herpès néonatal est estimée de l'ordre de 1 à 5 pour 10 000 grossesses, comme pour la rubéole congénitale.
L'infection du nouveau-né vient presque toujours d'un herpès génital maternel avec contamination de l'enfant au passage dans la filière génitale maternelle infectée. Dans les 2/3 des cas, l'herpès maternel est asymptomatique, révélé par l'herpès du nouveau-né. Cette explication de l'herpès du nouveau-né par un herpès génital maternel vient de la proportion élevée (4/5) des herpès du nouveau-né à HSV-2 et aussi du siège habituel des lésions cutanées au niveau de la présentation.
En fait, il existe pour la mère 4 situations possibles :
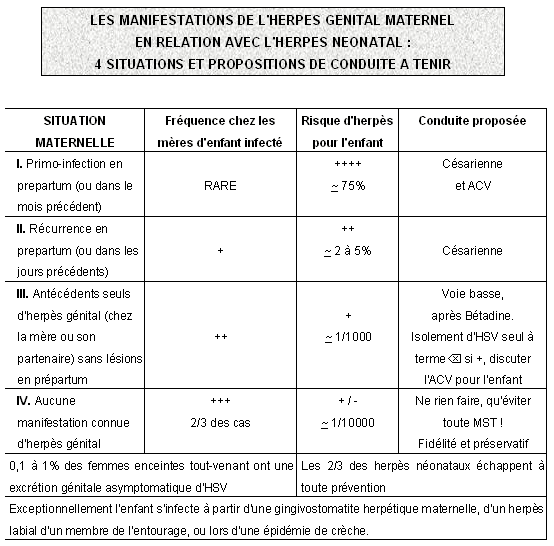
Situation I : la situation la plus grave pour l'enfant étant heureusement la plus rare, c'est l'herpès génital initial au moment du travail ou dans le mois précédant l'accouchement. Le risque est maximal pour l'enfant car c'est là que les lésions d'herpès génital peuvent être les plus importantes, avec une excrétion virale à titre élevé et durant en moyenne 3 semaines, cela sans anticorps naturel. Le risque pour l'enfant sans traitement de 75 %.
Situation II : c'est un herpès génital récurrent durant le travail ou dans la semaine précédant l'accouchement. C'est une situation plus fréquente que la précédente mais moins dangereuse par l'enfant (5%) du fait de lésions moins importantes, avec excrétion virale plus limitée en titre et en durée (3 jours en moyenne).
La situation III, simple histoire antérieure de poussée d'herpès génital (chez la mère elle-même ou son partenaire) sans lésion génitale à l'examen, comporte un risque pour l'enfant estimé à 1/1000.
La situation IV est la situation des femmes tout-venantes, sans lésions et sans histoire passée d'herpès génital chez elles ou leur partenaire. Le risque pour l'enfant est le plus réduit soit 1/10 000 (= valeur basse de la fourchette) mais puisqu'il concerne les femmes tout-venant, il est paradoxalement à l'origine des 2/3 des herpès du nouveau-né.
Contrairement à l'adulte, le nouveau-né ne fait pas d'herpès asymptomatique. Les formes bénignes (10 %) sont les formes strictement localisées et qui le restent, cutanées (vésicules en bouquet), buccales ou oculaires (conjonctivite). Les formes graves dominent et sont de 2 types : 1) l'infection disséminée à tous les organes, notamment hépatite nécrosante grave avec ictère, purpura, hémorragies muqueuses ; pneumonie avec détresse respiratoire ; méningo-encéphalite avec trouble de la conscience, hypotonie, crises convulsives. 2) l'infection localisée au système nerveux central est également grave.
Au total, la mortalité sans traitement est de 50 % avec des séquelles neuropsychiques graves chez 50 % des survivants.
Le traitement de l'herpès néonatal déclaré ou même simplement soupçonné est l'administration par perfusion intraveineuse d'ACV à forte dose durant 2 à 3 semaines, suivi d'un traitement de consolidation par ACV par voie orale pour éviter les récurrences au niveau cérébral.
Les moyens de prévention sont au nombre de quatre :
- l'éducation sexuelle avec, durant le dernier trimestre, stabilité du couple et usage du préservatif,
- la désinfection de la filière génitale par un désinfectant comme la polyvidone iodée (Bétadine) ou la Chlorexidine au moment du travail,
- la césarienne,
- l'ACV à la mère et à l'enfant en cas de risque majeur. Ces moyens 1 et 2 sont sans effets secondaires contrairement aux 2 derniers : risque de l'anesthésie pour la césarienne (qui augmente par 3 la mortalité maternelle par rapport à l'accouchement par voie basse) et pour l'enfant, risque théorique (faible) à long terme d'anomalies tardives par effet de l'ACV sur le DNA de l'enfant.
Il existe des herpès du nouveau-né par HSV-1, oral (1/3 des cas) en particulier des herpès du nouveau-né qui ne sont pas d'origine maternelle mais qui proviennent d'une autre personne de l'entourage : père ou personnel soignant. Donc un sujet souffrant d'une récurrence d'herpès labial ne doit pas embrasser un nouveau-né.
C. L’encéphalite herpétique de l’adulte
C'est une encéphalite qui touche surtout l'adulte avec même un pic de fréquence vers 40-50 ans. Ce n'est pas l'encéphalite qui fait partie du tableau de l'herpès néonatal, c'est une maladie tout à fait à part, toujours due à l'HSV-1. C'est d'ailleurs la plus fréquente des encéphalites virales, en France. C’est une encéphalite par multiplication intracérébrale du virus au niveau des neurones. Elle est généralement localisée au lobe temporal, souvent d'un seul côté, sous forme d'un foyer de nécrose hémorragique. C'est une maladie dramatique, qui débute brutalement par un syndrome infectieux, de la fièvre, et des signes encéphalitiques.
Selon les cas, ce sont des crises convulsives, des troubles du comportement, des paralysies, des aphasies, le plus souvent accompagnés de troubles de la conscience qui vont aller en s'aggravant jusqu'au coma. L'électroencéphalogramme est presque toujours perturbé, et souvent on trouve des signes de localisations à la tomodensitométrie ou à l’IRM, signes de localisations temporaux unilatéraux.
Rarement, on était amené à pratiquer une exploration neurochirurgicale, un trou de trépan temporal, pour éliminer l'hypothèse d'une tumeur cérébrale à développement rapide, pour éliminer un abcès cérébral qui est une maladie parfaitement curable et réversible à condition d'intervenir chirurgicalement. Ici cette intervention confirmerait le diagnostic d'encéphalite herpétique en montrant à travers le trou du trépan un lobe temporal nécrosé, hémorragique, œdémateux, en permettant, de faire une biopsie de cette zone morte.
En pratique, il faut apprendre à suspecter cliniquement une encéphalite herpétique et dès lors mettre en place d'urgence deux mesures simultanées :
- le traitement par ACV IV
- la recherche de DNA viral dans le LCR par PCR. Un traitement précoce est indispensable à une survie sans séquelle.
Ainsi un virus avec lequel nous vivons habituellement en bonne harmonie, peut exceptionnellement (50 à 100 cas par an en France) donner une maladie redoutable. On ne sait pas actuellement ce qui détermine la survenue exceptionnelle de l'encéphalite herpétique. Elle frappe des sujets sains. Tantôt c'est une primo-infection, tantôt et plus souvent, c'est une réinfection. On suppose alors une récurrence “ à rebours ”, du ganglion de Gasser vers le lobe temporal.
D. L’herpès chez l’hôte fragilisé
1/ Chez le sujet immunodéprimé, un greffé rénal ou sujet atteint de SIDA par exemple, il est fréquent et banal d'observer une élimination orale ou génitale d'HSV-1 ou 2. Parfois, ces infections se traduisent par les lésions extensives de l'herpès cutanéo-muqueux chronique : ulcérations buccales ou génitales, creusantes et persistantes, trachéite, oesophagite douloureuse ; chez certains sujets, une dissémination de l'infection aboutit à une hépatite, une pneumonie, une encéphalite.
2/ Chez un sujet à la peau abrasée par une brûlure ou par une dermatose suintante, un eczéma par exemple, l'inoculation d'un HSV peut aboutit à des lésions qui ont la dimension de la dermatose. Tel est l'eczéma herpétisé, grave et parfois mortel chez le nourrisson, et justiciable d’un traitement d’urgence à l'Aciclovir i.v. Un nourrisson eczémateux ne doit pas être embrassé par un sujet souffrant d'herpès labial.
2-5. Le diagnostic au laboratoire de virologie des infections à HSV-1 et 2
Quatre points sont à considérer pour tout diagnostic virologique médical: les indications, les prélèvements, les techniques et l'interprétation des résultats.
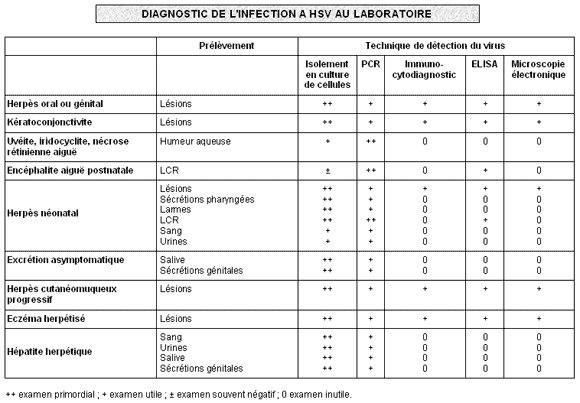
A. Les indications
L'herpès labial récidivant se passe de diagnostic au laboratoire, car la clinique suffit devant les lésions vésiculeuses et ulcérées de la jonction cutanéomuqueuse.
En revanche, l'herpès génital de l'homme ou de la femme exige confirmation virologique car c'est un diagnostic aux conséquences importantes pour l'avenir du sujet, homme ou femme : il est potentiellement contagieux pour son partenaire même en dehors de récurrence manifeste, de par une excrétion asymptomatique. De plus, la clinique est trompeuse. Enfin, reconnaître le type 1 au cours d'une primoinfection génitale permet de prédire qu'avec ce type les récurrences seront rares : seul le type 2 donne un herpès génital hautement récidivant.
Il va de soi que les manifestations graves de l'herpès exigent chaque fois que possible, confirmation virologique.
Il en va de même quand le sujet est inclus dans un protocole d'essai thérapeutique.
Enfin, le diagnostic virologique est utile en cas de résistance au traitement antiviral
Les moyens du diagnostic virologique. Ils sont, d’une façon générale, classés en deux catégories, comme suit : diagnostic direct par détection du virus ou de ses composants dans des prélèvements virologiques ; diagnostic indirect à la recherche d'une réponse immune (humorale, anticorps) dans le sérum. Mais cela est à moduler en fonction de chaque virus.
Ici, seul le diagnostic direct est significatif car il est généralement facile et rapide alors que la réponse immunitaire humorale ne se développe qu'après une ou deux semaines d'évolution et ne se modifie guère par la suite lors des récurrences. Oublions donc le sérodiagnostic même s'il est souvent demandé par des prescripteurs peu instruits de ce qu'est l'herpès.
Ainsi, les prélèvements visent à détecter le virus. Ils porteront chaque fois que possible sur les lésions : liquide de vésicule prélevé à la seringue, écouvillonnage énergique du plancher de la vésicule ou de l'ulcère avec expression de l'écouvillon dans un tube de milieu de transport. On fait un prélèvement de liquide céphalorachidien en cas d'encéphalite herpétique ou d'herpès disséminé du nouveau-né. Il est important de noter que les prélèvements sur lésion doivent intervenir avant toute application de désinfectant et sur des lésions fraîches ; au stade de croûte, c'est trop tard.
Les prélèvements pour recherche d'une excrétion génitale asymptomatique chez une femme enceinte à antécédents d'herpès génital pour elle-même ou son partenaire méritent qu'on s'y arrête ("situation III"du paragraphe 4.2.). C'est une recherche à faire une seule fois, lors du travail (avant toute désinfection à la Bétadine ou à la Chlorhexidine), par écouvillonnage après avoir éliminé, à l'aide d'un écouvillon qu'on jette, le bouchon muqueux du canal cervical, un deuxième écouvillon est introduit sur 1 ou 2 cm dans le canal cervical, tourné dans ce canal puis passé à la surface du col utérin, puis exprimé dans un tube de milieu de transport. Un troisième écouvillon est passé sur les faces interne et externe des petites lèvres pour être exprimé dans le même tube que l'écouvillon précédent.
B. Les techniques
Les techniques de détection du virus dans les prélèvements sont au nombre de trois : l'isolement du virus en culture de cellule, la détection d'antigène viral, la détection de séquences génomiques virales par PCR.
- L'isolement en culture de cellules est la technique de référence car HSV-1 et 2 se multiplient très bien, en cultures couramment utilisées au laboratoire (cellules VERO, fibroblastes humains, cellules KB). Ces virus donnent rapidement (en 24h à 4 jours) un effet cytopathique très évocateur : cellules bien rondes en foyer (grappe de raisin). Le diagnostic de type 1 ou 2 est confirmé en immunofluorescence (IF) ou en immuno-peroxydase (IP) avec des anticorps monoclonaux spécifiques de type 1 ou 2. Cette technique classique et sensible s'applique aussi bien à la recherche d'une excrétion génitale asymptomatique qu'aux lésions suspectes d'herpès.
- La recherche d'antigène peut se faire de deux façons: 1) sur un frottis des lésions apportant des cellules infectées où l'on va rechercher l'antigène par IF ou IP (comme pour les cultures infectées) c’est l’immuno-cytodiagnostic ; 2) par ELISA sur du liquide chargé d'antigène comme le liquide de vésicule ou le produit d'expression de l'écouvillonnage de lésions, comme le LCR, en cas de méningo-encéphalite.
Cette recherche d'antigène n'est pas aussi sensible, ni spécifique, que l'isolement en culture en cas d’herpès oral ou génital. Son avantage est la rapidité de réponse. Elle ne s'applique pas à la recherche d'une excrétion asymptomatique car elle y serait faussement négative.
- La recherche de DNA par PCR sur le LCR : c'est le meilleur moyen de diagnostic rapide d'une méningo-encéphalite herpétique. Cette technique est très sensible, positive dans plus de 90 % des encéphalites herpétiques et très spécifique. En cas de négativité, l’examen doit être répété sur un deuxième prélèvement même si le sujet est traité par aciclovir
C. L’interprétation
La découverte du virus au niveau des lésions est un argument très fort en faveur de leur origine herpétique. En revanche, une excrétion de virus dans la salive au cours d'un syndrome encéphalitique fébrile n'est pas le signe certain de son origine herpétique : ce peut être un virus de sortie au cours d'une encéphalite d'autre nature !
2-6. Traitement

C'est essentiellement l'acycloguanosine appelée aciclovir (ACV ou Zovirax®). L'ACV est administré selon les cas par perfusion IV (formes graves), par la bouche (pour les affections moins sévères) ou en application oculaire dans la kérato-conjonctivite à HSV-1. On a vu que par application locale, on pouvait utiliser des nucléosides antiviraux plus ou moins cytotoxiques comme l'IdU. Il en va de même de la trifluorothymidine ou TFT. Une indication de l'ACV est l'herpès génital hautement récidivant où la prise continue de 0,6 à 0,8 g/j permet de prévenir temporairement les poussées. L'ACV, en tant qu'inhibiteur de la réplication du DNA viral, n'a pas d'action sur les virus latents dans les ganglions sensitifs, puisque leur DNA ne se réplique pas. Ainsi l'ACV n'éradique pas l'infection, de sorte que les poussées reviennent à l'arrêt du traitement. Le valaciclovir (ZélitrexÒ), converti rapidement en ACV, a une biodisponibilité 5 fois supérieure à celle de ACV, permettant un traitement curatif et préventif des récurrences de l'herpès génital avec seulement deux voire une prise quotidienne.
Un dérivé de pyrophosphate, l'acide phosphonoformique, (Foscavir) est utilisé quand le virus est résistant à l'ACV. Ce peut être le cas lorsque sont traitées les lésions herpétiques à charge virale très élevée des sujets immunodéprimés.
Il n'y a malheureusement pas de vaccin actuellement au point contre l'herpès.
2-7. Rappel des points importants
- La primo-infection à HSV-1 et HSV-2 est habituellement asymptomatique.
- Il peut survenir des excrétions asymptomatiques de virus dans la salive ou les sécrétions génitales, assurant la dissémination de l'infection aux sujets réceptifs, aux jeunes enfants par relation de maternage et aux adultes par relation sexuelle. C'est le portage asymptomatique qui propage l'infection à HSV, par des contaminations souvent "innocentes".
- C'est une faute grave (risque de perforation cornéenne) de mettre un collyre aux corticoïdes sur un œil rouge et douloureux sans avoir éliminé une conjonctivite herpétique.
- Il faut apprendre à suspecter cliniquement une encéphalite herpétique, car seul un traitement très précoce assure une survie sans séquelle.
- La prévention de l'herpès néonatal repose sur la prévention de l'herpès génital de la mère et du partenaire avant la naissance, grâce à l'éducation sexuelle.
- Un nourrisson eczémateux ne doit pas être embrassé par un sujet souffrant d'herpès labial.
- L'herpès génital de l'homme et de la femme exige une confirmation virologique par culture des prélèvements de lésions suspectes.
- Le traitement des infections herpétiques repose sur l'administration d'aciclovir (IV, PO, application oculaire) ou de valaciclovir (PO). Toutefois, il ne permet pas d'éradiquer l'infection herpétique latente du ganglion sensitif. Ainsi, il n'y a pas de traitement curatif mais seulement suspensif de l'herpès récidivant labial ou génital.
3. LE VIRUS DE LA VARICELLE ET DU ZONA (VZV)
Le virus de la varicelle et du zona (VZV) est un herpesviridæ dermo-neurotrope, la varicelle étant la primoinfection et le zona une récurrence, généralement unique.
La varicelle est une infection généralisée à point de départ respiratoire. Elle peut être mortelle chez le sujet immunodéprimé, justifiant le recours à l'aciclovir.
Le zona est une récurrence à localisation radiculaire. Il peut se compliquer chez le sujet âgé de douleurs résiduelles très intenses.
C'est le même virus qui détermine ces deux maladies. La varicelle est la primo-infection de l'enfant. Le zona est la récurrence de cette infection et touche habituellement l'adulte.
Ce virus de la famille des herpesviridæ a quelques particularités.
Il est strictement humain. Au laboratoire, il se multiplie dans les cultures de cellules humaines (fibroblastes humains) ou des cellules de singe (cellules vero). Il donne un effet cytopathique analogue à celui des HSV-1 et 2, mais lent, très difficile à transmettre aux cultures de cellules. L'isolement du virus par inoculation de cultures cellulaires est donc aléatoire. Cela contraste avec le caractère très contagieux de la varicelle chez l'homme. Un sujet qui n'a jamais eu la varicelle est presque sûr de contracter cette maladie s'il approche un malade.
3-1. La varicelle
A. La forme classique
C'est donc la primo-infection. Elle est presque toujours apparente. Le virus est inhalé. Il se multiplie à la porte d'entrée dans l'arbre respiratoire puis se dissémine dans l'organisme par virémie. Tout ce cheminement du virus se fait sans manifestations cliniques, d'où une période d'incubation de 12 à 20 jours en moyenne de 15 jours, silencieuse, jusqu'à l'apparition de l'éruption varicelleuse.
La varicelle est ainsi une virose généralisée ; donc elle a une incubation longue.
Pratiquement, il n'y a pas de phase d'invasion et l'éruption dans la moitié des cas apparaît en même temps qu'une fièvre modérée à 38-38°C5. Cette éruption comporte un exanthème et un énanthème. L'exanthème apparaît sur le tronc "sous la chemise". Il parcourt les stades suivants : macules, papules, vésicules. Il n'y a pas de pustules. Les éléments ne vont donc pas au-delà du stade de vésicules, vésicules pleines d'un liquide clair, transparent "en goutte de rosée". Ultérieurement la vésicule s'aplatit, se dessèche, apparaît une croûte, et la guérison se fait sans cicatrice, à moins que l'enfant ne se soit gratté, ce qui n'est pas rare.
Fait essentiel, il y a plusieurs poussées, 2 à 3, de sorte qu'à un moment donné on observe dans un territoire la juxtaposition d'éléments d'âge différent : des macules mélangées à des papules, et à des vésicules. Ce signe permet le diagnostic de la varicelle au premier coup d'œil.
La varicelle est une maladie bénigne. Les complications sont rares. L'encéphalite de la varicelle est exceptionnelle (2/10.000). C'est une encéphalite par démyélinisation périveineuse et non pas par multiplication intracérébrale de virus. Très souvent elle est localisée au cervelet, réalisant une ataxie cérébelleuse aiguë, c'est-à-dire des troubles de l'équilibre. Cette ataxie régresse sans séquelles.
[L'encéphalite de la varicelle est une encéphalite post-éruptive apparaissant en moyenne 5 jours après l'exanthème. Plus grave mais exceptionnel : le syndrome de Reye (encéphalopathie œdémateuse + dégénérescence graisseuse aiguë du foie) qui survient parfois au décours d'une varicelle comme d'une grippe B. La prise d'aspirine joue un rôle dans l'apparition de ce syndrome].
B. Les formes graves
1/ Chez le nouveau-né
On peut observer une varicelle néo-natale grave à la suite d'un fâcheux concours de circonstances : il faut une mère parvenue à l'âge adulte sans avoir fait la varicelle, de sorte que son enfant ne reçoit pas d'anticorps maternels anti-varicelle. Il faut donc que cet enfant soit contaminé peu avant sa naissance, par sa mère. Cette varicelle de nouveau-né est mortelle dans 20 à 30 % des cas par dissémination de l'infection à tous les organes (atteinte polyviscérale).
La varicelle en début de grossesse (24 semaines) donne de façon exceptionnelle (2%) une embryopathie dont la forme la plus grave est caractérisée par une atrophie cicatricielle des membres, des anomalies de la peau et du cortex cérébral.
2/ Chez l’adulte
Lorsque la primo-infection survient tardivement chez un adulte, on risque une pneumonie nodulaire diffuse, qui est mortelle dans 10 % des cas. Quand elle guérit, elle laisse souvent des nodules calcifiés dans le parenchyme pulmonaire.
Donc il y a un "bon âge" pour faire la varicelle, ni trop tôt, ni trop tard.
3/ Chez les sujets immunodéprimés, la varicelle est souvent grave réalisant ce qu'on appelle une varicelle progressive : les éléments sont nombreux, de grande taille, hémorragiques, nécrotiques parfois, sans tendance à la guérison. Surtout on risque une dissémination du virus à tous les organes, foie, poumons, encéphale (atteinte polyviscérale). La mortalité de cette varicelle progressive est très élevée si on ne traite par Aciclovir. Cette évolution se voit chez des sujets soumis à un traitement immunodépresseur ou à des corticoïdes, surtout lorsque ces traitements sont prescrits pour une maladie leucémique ou cancéreuse qui en elle-même est déjà immuno-déprimante. De tels enfants, s'ils n'ont pas fait la varicelle, doivent être écartés de tout risque de contage et vaccinés en période de rémission. S'ils sont soumis à un contage, il faut de toute urgence leur administrer des gamma-globulines (qui sont actuellement non disponibles en France) Cette injection de gamma-globulines par voie intra-musculaire est partiellement efficace, à deux conditions :
- elle doit être faite dans les 72 heures après le contage,
- il faut recourir à des gamma-globulines spéciales provenant de donneurs sélectionnés sur un titre d'anticorps élevé vis-à-vis du virus VZ. Par exemple on choisit comme donneurs de gamma-globulines des adultes qui viennent de faire un zona. On leur associe actuellement de l'Aciclovir per os ou IV.
La varicelle grave risque de se compliquer aussi de coagulation intravasculaire disséminée (CIVD), de surinfections bactériennes graves. Par ailleurs, chez un enfant leucémique, ou traité pour tumeur maligne, le risque de varicelle grave - la simple annonce d'un contage - conduit à interrompre la chimiothérapie, ce qui peut faire manquer la guérison de la leucémie ou de la tumeur maligne.
3-2. Le Zona
Il survient le plus souvent à l'âge mûr mais parfois plus tôt en cas d'immunodépression, exceptionnellement chez l’enfant.
Le zona est une réinfection endogène, une récurrence ou résurgence de l'infection chez un sujet qui a déjà fait la varicelle, et qui possède donc des anticorps. D'autre part c'est une maladie essentiellement locale (la virémie étant transitoire et faible). On ne sait pas si lors de la varicelle, le virus se localise dans un seul ganglion sensitif, mais plus tard, c'est généralement dans un seul ganglion sensitif que l'infection se trouve réactivée pour donner le zona.
C'est un ganglion qui correspond au territoire où l'éruption de la varicelle avait été particulièrement intense : c'est en général le tronc et vient ensuite la tête. Une fois réactivée l'infection migre par voie neuronale centrifuge vers la peau et les muqueuses. On a alors deux manifestations cliniques : d'abord une névralgie, c'est-à-dire une douleur à type de brûlures, sur le trajet du nerf, puis une éruption vésiculeuse localisée au territoire cutanéo-muqueux innervé par ce ganglion sensitif. Donc une éruption à topographie nerveuse, radiculaire, unilatérale, douloureuse.
Le zona le plus fréquent est le zona thoracique ou abdominal mais il y a aussi des zonas sacrés (touchant le périnée, les organes génitaux, la fesse) et à l'autre extrémité, des zonas céphaliques correspondant à l'atteinte des nerfs crâniens.
Le zona est souvent bénin, mais il pose des problèmes dans trois circonstances :
1/ Chez le sujet de plus de 60 ans, le zona laisse souvent, après la guérison des vésicules, des douleurs névralgiques extrêmement vives, et tenaces, cause d'état dépressif conduisant parfois au suicide. Ce sont les algies post-zostériennes (APZ). Elles sont définies par la persistance de douleurs au delà de 6 mois.
2/ Il existe un risque d'atteinte cornéenne en cas de zona ophtalmique, c'est-à-dire de zona dans le territoire du nerf ophtalmique de Willis, branche du trijumeau. [Ce risque se voit particulièrement en cas d'atteinte de la branche nasale externe du nerf ophtalmique de Willis, ce qui se traduit par l'apparition de vésicules sur l'aile du nez. Aile du nez et cornée sont innervées par le même nerf ; il existe aussi un risque d’atteinte rétinienne responsable d’une nécrose rétinienne aiguë ayant tendance à se bilatéraliser, nécessitant un traitement par aciclovir à vie].
3/ Chez le sujet immunodéprimé (pour cancer ou hémopathie maligne, ou SIDA par exemple) le zona survient à n'importe quel âge et il est volontiers extensif. Il peut y avoir virémie, l'éruption peut dépasser le territoire du ganglion sensitif sous forme d'une éruption généralisée ressemblant fort à la varicelle de primo-infection; il peut y avoir une atteinte polyviscérale.
Contrairement à la varicelle, le zona en cours de grossesse ne fait courir aucun risque au fœtus, car c'est une maladie localisée sans virémie.
3-3. La transmission de l’infection à virus VZ
La varicelle se transmet à partir du liquide de vésicules et surtout à partir des sécrétions respiratoires des sujets atteints de la varicelle. Dès le stade des croûtes, qui ne contiennent pas de ce virus très peu résistant, la contagiosité cesse. Cette transmission est strictement interhumaine, directe, respiratoire, en face de sujets atteints de varicelle. Un varicelleux est déjà contagieux quelques jours avant l'apparition de l'éruption. Les épidémies de varicelle sont plus fréquentes l'hiver que l'été.
En ce qui concerne le zona, il n'y a pas de transmission du zona, puisque c'est une réinfection endogène. Parler de contage ou d'incubation en matière de zona est un non-sens. Les récurrences de zona se répètent rarement (environ une fois dans la vie d’un sujet immunocompétant), pas autant que le font, souvent, les récurrences d'herpès.
Il n'y a donc pas d'épidémie de zona, mais les vésicules de zona contenant le virus, un zona peut être à l'origine d'une épidémie de varicelle, par exemple dans les unités de cancérologie ou d'hématologie infantile. Le zona d'un grand-parent peut être à l'origine de la varicelle de ses petits-enfants. C'est tout de même rare car il y a moins de vésicules dans le zona, que dans la varicelle.
3-4. Le diagnostic
Le diagnostic de la varicelle et du zona est essentiellement clinique. Cependant il y a des indications du diagnostic virologique exact :
- les formes graves de varicelle ou de zona
- une éruption atypique dans l'entourage d'un sujet immunodéprimé
- toute étude à visée épidémiologique, sémiologique, pronostique ou thérapeutique, sur la varicelle ou le zona
- la détermination de l'immunité chez un sujet jeune avant mise sous un traitement immunodépresseur.
On dispose pour cela de 2 approches, avec 3 techniques comme d'habitude : le diagnostic rapide, l'isolement et le sérodiagnostic.
A. Diagnostic direct
La technique de référence est l'inoculation du liquide de vésicules directement sur cultures de cellules si possible au lit du malade. Rappelons que c'est un virus très fragile et cultivant difficilement, l'ECP apparaissant au plus tôt 3 jours après l'inoculation.
La recherche d'antigène viral par immuno-cytodiagnostic en immunofluorescence sur frottis ou en immuno-peroxydase à partir de cellules du liquide de vésicule ou du plancher de la vésicule constitue un diagnostic rapide. La recherche du génome viral par PCR s’effectue sur liquide de vésicule mais surtout sur le LCR en cas de signe neurologiques et sur le liquide amniotique en cas de varicelle maternelle.
B. Diagnostic indirect
LE SÉRODIAGNOSTIC, à la recherche d'une réponse immune (humorale, anticorps) dans le sérum, se fait en pratique essentiellement en ELISA. Comme dans le cas des HSV de type 1 et 2, le sérodiagnostic est surtout intéressant en cas de primo-infection, c'est-à-dire, en cas de varicelle. Là l'examen simultané de S1 et S2 décèle une élévation significative du titre des anticorps, si les dates de prélèvement sont correctes. Pour le zona, le sérodiagnostic a moins d'intérêt car l'élévation du titre des anticorps s'observe moins constamment. Il faut donc privilégier l'isolement si l'on veut vraiment faire un diagnostic virologique.
En revanche, il est intéressant de faire un sérodiagnostic en ELISA aux personnes adultes sans antécédents connus de varicelle exposées à un contage, pour déterminer leur statut immunitaire et en l'absence d'anticorps VZV instituer un traitement préventif afin d'éviter la varicelle grave de l'adulte.
3-5. Le traitement des infections à VZV
A. Traitement curatif
Rien dans les formes habituelles, bénignes, si ce n'est des soins locaux.
Dans les formes graves d'infections à VZV, l'Acycloguanosine ou Aciclovir (ACV ou Zovirax) a prouvé son activité par voie veineuse. Cependant, le VZV étant moins sensible à l'ACV que les HSV, les doses actives per os sur le VZV sont de 4 g/j soit le quintuple des doses actives per os sur les HSV (0,8 g/j). C’est pourquoi, chez immunodéprimé, le traitement s’effectue par voie veineuse.
Des produits proches de l'ACV tel le Valaciclovir (Zélitrex®) et le Famciclovir (Oravir®) ont pour eux de passer plus aisément que l'ACV la barrière intestinale (meilleure biodisponibilité orale) et ils ont la préférence sur l’ACV pour le traitement des formes non graves.
B. Traitement préventif
Ce traitement repose sur l'administration de gammaglobulines à titre élevé en anticorps varicelle-zona, gammaglobuline spéciales anti-VZV. Ce traitement préventif s'adresse aux sujets réceptifs et à risque de varicelle grave et soumis à un contage. Malheureusement, les immunoglobulines ne sont pas disponibles en France actuellement.
Ces gammaglobulines sont sans intérêt pour le traitement curatif de la varicelle du zona. Pour la prévention des varicelles graves on tend actuellement à associer aux gammaglobulines spéciales anti-VZV un traitement IV à l'Aciclovir (Zovirax) ou oral au Valaciclovir ou au Famciclovir.
C. Le vaccin VZV Oka
C'est un vaccin vivant atténué, obtenu à partir d'une souche naturelle ("sauvage") isolée d'un enfant japonais appelé Oka et passée en série en cultures de cellules. Il a d'abord été destiné aux enfants immunodéprimés réceptifs au virus de la varicelle. C'est le seul exemple de vaccin vivant administrable à des sujets immunodéprimés. On a pris ainsi des risques, mais des risques très inférieurs à ceux de la varicelle naturelle chez ces sujets. On vaccine en période d'immunodépression modérée, en dehors du traitement d'attaque de la leucémie, ou avant greffe d'organe. Ce fut un succès :
- ce vaccin n'est pas dangereux pour ces enfants immunodéprimés, bien qu'il puisse donner quelques vésicules (une "minivaricelle") et qu'il puisse installer une infection latente dans les ganglions sensitifs comme le fait le virus sauvage.
- il évite aux enfants vaccinés de faire une varicelle grave en cas de rencontre du VZV sauvage.
Ce vaccin est également intéressant pour un adulte sain réceptif, surtout s'il est professionnellement exposé, afin de lui éviter la pneumonie à VZV qui au-delà de l'enfance peut être mortelle.
La vaccination "universelle" des nourrissons entre 12 et 18 mois pratiquée aux USA n'est pas retenue en France : on craint que l'immunité vaccinale, moins solide que l'immunité naturelle, aboutisse à repousser l'âge d'acquisition de l'infection naturelle, avec un risque accru de pneumonie grave. D'autre part remplacer le VZV sauvage par le vaccin VZV Oka au niveau de nos ganglions sensitifs à l'échelle de la population est une intervention artificielle dans une coévolution millénaire homme-virus, aux conséquences inconnues. Et puis, on a d'autres soucis de Santé Publique en France que l'absentéisme parental pour cause de varicelle : nos morts annuelles par le tabac (60 000), l'alcool (25 000), l'auto/moto (7 600), le suicide (12 000).
3-6. Rappel des points importants
- La varicelle, primo-infection par le VZV, est presque toujours apparente et peut être mortelle chez le sujet immunodéprimé, justifiant alors le traitement par l'aciclovir.
- Le zona est une réinfection endogène, une récurrence généralement unique.
- Le zona est une éruption de topographie radiculaire, unilatérale et douloureuse.
- Il n'y a pas d'épidémie de zona, mais les vésicules contenant le virus, un zona peut être à l'origine d'une épidémie de varicelle.
- Le traitement curatif de formes graves repose sur l'administration d'aciclovir par voie veineuse chez l'immunodéprimé. Pour les formes non graves de l'immunocompétent qui sont traitées, le traitement repose sur le valaciclovir ou le famciclovir.
- Pour tenter de prévenir les algies post-zostériennes chez le sujet de plus de 50 ans, on recourt au valaciclovir ou au famciclovir par voie orale, administré impérativement dans les 72 heures après le début du zona.
4. LE CYTOMÉGALOVIRUS HUMAIN (HCMV ou plus couramment CMV)
4-1. Le virus et sa multiplication
Le génome du CMV est le plus long et le plus complexe des génome des herpes virus. Il est constitué d’une molécule d’ADN double brin d’environ 250 000 paires de bases. La particule virale comprend 35 à 40 protéines. La capside virale est composée de la protéine majeure de capside de 150 kDa et de la protéine mineure de 34 kDa. Le tégument est composé des phosphoprotéines de 150kDa, de 55 kDa (pp65) et de 71 kDa. L’enveloppe porte des glycoprotéines impliquées dans l’absorption de la particule virale sur les récepteurs cellulaires (gp55), la fusion avec la membrane cellulaire, l’assemblage du virion et la sortie des virus produits de la cellule infectée.
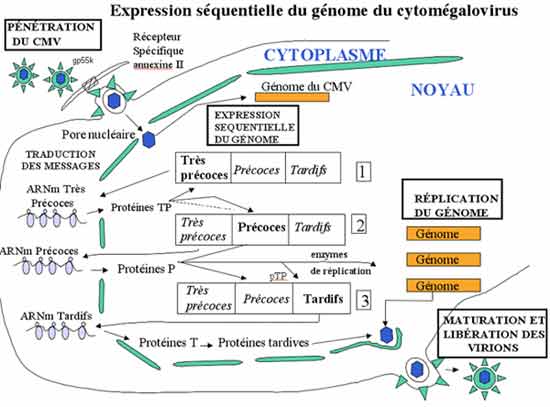
La réplication du CMV comporte, comme pour les autres herpesviridæ 3 phases :
“très précoce” avec synthèse de protéines activatrices ; “précoce” avec synthèse de protéines enzymatiques dont une DNA polymérase virale ; et “tardive” avec synthèse des composants protéiques de la capside et des glycoprotéines d’enveloppes. La réplication du DNA viral sépare les phases précoces et tardives.
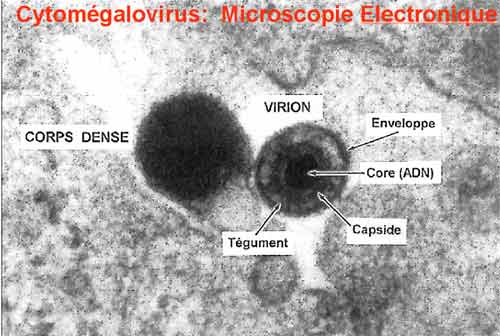
4-2. L’épidémiologie de l’infection à CMV
Virus strictement humain, le CMV est très ubiquitaire, infectant 50% de la population adulte dans les pays industrialisés et près de 100% de la population adulte dans les pays à bas niveau socio-économique.
Le virus est présent chez l’hôte infecté dans les leucocytes du sang, il peut être excrété dans la salive, l’urine, les larmes, les sécrétions cervico-vaginales, le sperme, le lait maternel. Il est transmis par contact direct par voie aéro-pharyngée, sexuelle, par transfusion de sang non déleucocyté, greffe d’organe et de la mère au fœtus ou au nouveau-né.
4-3. La physiopathologie de l’infection à CMV
Au moment de la primo-infection le virus diffuse par voie sanguine associé à la fraction leucocytaire du sang et atteint ces organes cibles. Le virus peut infecter les monocytes et macrophages tissulaires, les cellules endothéliales et probablement les cellules épithéliales. Après diffusion hématogène on le retrouve dans les glandes salivaires, dans les poumons, dans le rein, dans le foie et dans les épithéliums génitaux.
La réponse immunitaire spécifique associe
- une réponse humorale dont le rôle semble mineur
- une réponse de type cellulaire notamment CD8 cytotoxique.
Cependant, la réponse immunitaire est inefficace pour éliminer le CMV de l’organisme. En effet, le virus développe des stratégies pour échapper à cette réponse immunitaire. Par un mécanisme de mimétisme moléculaire le virus peut échapper à la réponse immunitaire cellulaire : par exemple il peut séquestrer des chimiokines dans l’environnement cellulaire en exprimant des molécules homologues des récepteurs des chimiokines. Il peut aussi inhiber l’expression des molécules du CMH de classe I ou II et limiter ainsi la lyse des cellules infectées.
Ainsi, une latence virale s’établie à vie dans les monocytes/macrophages sanguins, rénaux et pulmonaires et probablement aussi dans les cellules endothéliales vasculaires. Le génome viral persiste sous forme épisomale.
Des réactivations virales peuvent survenir, elles sont probablement fréquentes en effet, on a pu montrer que le virus est présent dans les sécrétions cervicales de 10 % des femmes enceintes mais elles sont sans traduction clinique chez le sujet sain. En revanche, les réactivations virales sont très fréquentes et parfois très graves en cas d’immunodépression.
Par ailleurs, la présence d’anticorps n’empêche pas les réinfections virales par de nouvelles souches de CMV. La fréquence de ces réinfections n’est pas connue.
4-4. Les manifestations cliniques de l’infection à CMV :
A. L’infection congénitale à CMV


L’infection congénitale à CMV est très fréquente en effet 1% des enfants sont infectés in utero et excrètent du virus dans leur urine à la naissance.
L’infection congénitale est acquise à l’occasion d’une virémie maternelle pendant la grossesse qui peut se compliquer d’une atteinte placentaire et d’une atteinte fœtale. La fréquence des primo-infections pendant la grossesse est d’environ 1% alors que les réactivations compliquent 5% des grossesses. La transmission au fœtus a lieu dans 30% des cas lors d’une primo-infection maternelle et dans moins de 5% des cas lors d’une réactivation. Ainsi, l’infection congénitale est secondaire à une primo-infection maternelle dans environ 50% des cas et à une réactivation maternelle dans un cas sur deux.
- 10 à 20% des enfants infectés congénitalement sont symptomatiques à la naissance.
Ces enfants présentent des manifestations cliniques plus ou moins sévères .
Le tableau clinique le plus grave réalise la maladie des inclusions cytomégaliques qui associe deux séries de symptômes :
- des signes d’infection générale : hépatosplénomégalie, ictère, thrombopénie, pneumonie, chez un enfant de petit poids (< 2,5 kg, retard de croissance).
- des signes d’atteinte céphalique : microcéphalie, calcifications intracérébrales périventriculaires, choriorétinite.
La mortalité de ces enfants est élevée (30%), les survivants ont de lourdes séquelles psychomotrices et sensorielles.
- 80 à 90% des enfants infectés sont asymptomatiques à la naissance.
Cependant 5 à 15% auront des séquelles : le plus souvent une perte d’audition qui peut-être uni ou bilatérale ou exceptionnellement un retard psychomoteur.
B. L’infection à CMV chez l’enfant et l’adulte immunocompétents.
La primo-infection a CMV est asymptomatique dans la très grande majorité des cas. Cependant, elle peut parfois se manifester sous forme de fièvre et/ou d’asthénie prolongée, de syndrome mononucléosique (à différencier de la mononucléose à virus Epstein-Barr et de la primo-infection à HIV, de la toxoplasmose), de leucopénie, sous forme d’hépatite aiguë (ni A, ni B, ni C), exceptionnellement sous forme de syndrome de Guillain-Barré, de pneumonie ou d'encéphalite.
C. L’infection à CMV après allogreffe d’organe et de moelle
Trois mode d’infection sont possibles : une primo-infection chez un receveur séronégatif avant la greffe, une réinfection par une nouvelle souche de CMV apportée par l’organe greffé ou la réactivation d’une infection latente chez un receveur positif avant la greffe.
En l’absence de traitement prophylactique, l’infection à CMV est observée chez deux tiers de receveurs de greffe entre 1 à 4 mois après la greffe. L’infection à CMV est symptomatique deux fois sur trois et se manifeste par l’apparition d’un syndrome fébrile souvent compliqué d’une thrombo-leucopénie et d’une hépatite cytolytique. L’infection à CMV déclenche ou accélère le rejet de greffe.
L’infection à CMV peut se compliquer de maladie à CMV avec une atteinte du tube digestif à type d’ulcérations digestives (bouche, œsophage, colon, anus), une glomérulopathie, et chez les greffés de moelle d’une pneumonie intersticielle gravissime (50 % de mortalité lorsqu’elle est déclarée, même traitée par un antiviral anti-CMV efficace).
D. L’infection à CMV au cours du SIDA
L’incidence des infections à CMV a diminué de 80% depuis l’instauration des traitements anti-rétroviraux efficaces. Les manifestations cliniques liées au CMV surviennent à un stade d’immunodépression majeure (< 200 CD4/mm3). La manifestation la plus fréquente est la rétinite à CMV qui conduit à la cécité en l’absence de traitement.
4-5. Le diagnostic de l’infection à CMV au laboratoire de Virologie
A. Les méthodes du diagnostic virologique d’une infection à CMV
-Le diagnostic direct : mise en évidence du virus ou de ses constituants
- La culture virale
La culture virale peut être réalisée à partir de divers prélèvements : sang, urines, biopsies, LCR, salive, lavage broncho-alvéolaire ou liquide amniotique. Il est impératif que ces prélèvements soient acheminés rapidement au laboratoire afin d’y être rapidement inoculés. Cette contrainte majeure de la culture virale est liée à la fragilité du virus qui survit peu de temps dans le milieu extérieur. L’utilisation de milieux de transports viraux permet de pallier à cette fragilité et d’assurer la survie du virus pendant quelques heures; cependant ces milieux ne sont pas utilisables pour les prélèvements sanguins.
La culture virale consiste à inoculer les prélèvements sur une nappe subconfluente de cellules fibroblastiques embryonnaires humaines en culture. Il existe deux méthodes pour révéler la présence du virus qui s’est multiplié dans les cellules fibroblastiques : la technique classique qui consiste à attendre la survenue d’un effet cytopathique, et la technique rapide qui met en évidence la présence de protéines virales précoces par immunofluorescence ou par réaction immunoenzymatique en utilisant un anticorps monoclonal dirigé contre une protéine précoce du CMV.
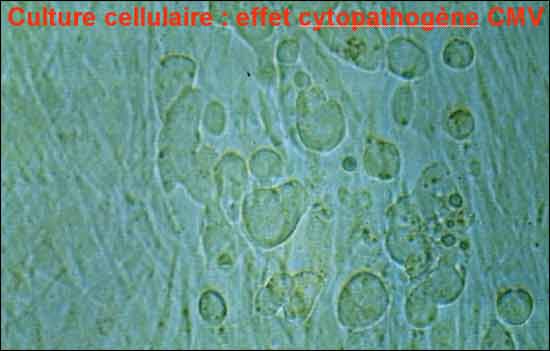
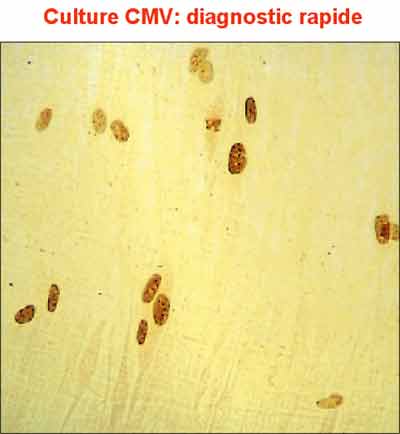
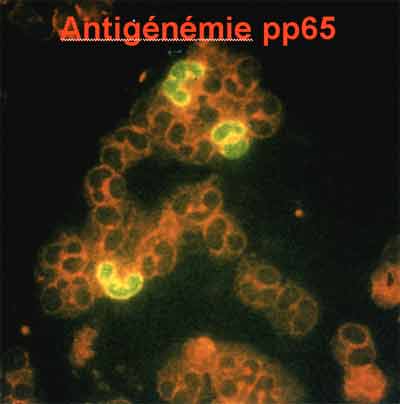
- L’antigénémie pp65
Cette technique, dont le principe est simple, permet de détecter et de quantifier le nombre de cellules sanguines circulantes infectées par le CMV en phase réplicative. La présence du CMV dans les leucocytes est révélée par immunofluorescence à l’aide d’anticorps monoclonaux dirigés contre la protéine du tégument pp65.
La détection de l’antigénémie pp65 est beaucoup plus sensible que la culture virale pour détecter une virémie à CMV et a largement supplanté cette dernière.
- Les techniques de biologie moléculaire : l’amplification génique («Polymerase Chain Reaction» ou PCR)
Les techniques de biologie moléculaire sont de plus en plus utilisées pour le diagnostic des infections à cytomégalovirus. Elles présentent en effet l’avantage, par rapport aux techniques de culture cellulaire ou à l’antigénémie pp65, d’être réalisables de manière différée sur des prélèvements stockés congelés et d’être rapides, sensibles et automatisables Ces techniques peuvent être réalisées sur de nombreux prélèvements (plasma, leucocytes, urines, LCR, biopsies, liquide amniotique.
Le développement récent des techniques de PCR quantitatives en temps réel qui sont simples et peu coûteuses va probablement révolutionner le diagnostic virologique par biologie moléculaire, et leur application au diagnostic des infections à CMVH est de plus en plus diffusé.
- Le diagnostic indirect de l’infection à CMV est la sérologie
La recherche d’IgG et IgM anti-CMV est actuellement réalisée à l’aide de trousses ELISA commerciales. Les IgM anti-CMV peuvent persister 16 à 20 semaines après une primo-infection, cependant il faut rappeler qu’elles ne sont pas spécifiques de la primo-infection puisqu’elles peuvent être aussi détectées lors d’une réactivation virale à CMV.
B. La démarche diagnostique de l’infection à CMV dans les différentes situations cliniques

- Le diagnostic de la primo-infection à CMV chez le sujet immuno-compétent repose sur la sérologie:
- essentiellement sur la mise en évidence d’une séroconversion des IgG entre deux prélèvements pratiqués à distance l’un de l’autre.
- sur la mise en évidence d’IgM anti-CMV en sachant que la positivité des IgM ne permet pas d’affirmer une primo-infection. En effet, les IgM peuvent être présentes en cas de réactivation, bien que généralement à un taux plus faible que lors d’une primo-infection.
- Le diagnostic de l’infection maternofoetale à CMV
- Le diagnostic de l’atteinte du fœtus pendant la grossesse repose sur la mise en évidence par PCR du CMV dans le liquide amniotique qui est très riche en virus en cas d’infection.
- Le diagnostic de l’infection à CMV à la naissance repose sur la mise en évidence du CMV par mise en culture des urines prélevées lors de la première semaine de vie.
- Le diagnostic de la réactivation de l’infection à CMV chez les immunodéprimés
- Le diagnostic de l’infection à CMV chez les transplantés. L’intérêt majeur du suivi virologique des patients en post greffe est de diagnostiquer l’infection à CMV lorsqu’elle débute afin d’instaurer un traitement dit «préemptif» qui permet d’éviter le développement ultérieur de la maladie à CMV. Le diagnostic virologique de l’infection à CMV va reposer sur la mise en évidence d’une réplication virale dans le compartiment sanguin. La plupart des laboratoires utilisent l’antigénémie pp65 pour le suivi de l’infection à CMV en post greffe. Les tests de PCR quantitative commencent à être utilisés dans certains laboratoires, les PCR en temps réel semblent en particulier très prometteuses.
- Le diagnostic de l’infection à CMV chez le patient VIH. La survenue d’une réactivation à CMV chez ces patients est diagnostiquée par le test de l’antigénémie pp65, seule une positivité supérieure à 100 noyaux pour 100 000 cellules est prédictive de la maladie à CMV chez les patients atteints de SIDA.
4-6. Traitement
A. Pas de vaccin actuellement au point contre le CMV.
B. Traitement des infections à CMV chez les immuno-déprimés.
On dispose de deux médicaments antiviraux, la DHPG ou Ganciclovir et l'acide phosphonoformique (PFA) ou Foscarnet, administrés par perfusion intra-veineuse dans le traitement des infections graves des sujets immunodéprimés. Ces deux antiviraux spécifiquement anti-CMV ont des effets secondaires sérieux : neutropénie pour la DHPG, anémie et insuffisance rénale pour le PFA. Un troisième médicament, l’HPMPC (Cidofovir ou VistidÒ), néphrotoxique, est utilisé en cas de résistance aux deux précédents.
C. Prise en charge des infections congénitales à CMV.
Les mesures pour tenter d'éviter les infections congénitales sont de portée très limitée du fait que les signes d'alarme chez la femme enceinte sont très rares, du fait de l'absence de vaccin efficace, de l’absence de traitement antiviral utilisable pendant la grossesse. D'où, par opposition à ce qu'il en est en matière de rubéole ou de toxoplasmose l'absence actuellement d'une politique systématique de prévention. Cela ne fait que souligner l'intérêt des mesures ponctuelles suivantes, en attendant la mise au point d'un vaccin :
- Contrôler l'immunité des femmes jeunes en âge d'être enceintes et susceptibles de soigner des nouveau-nés atteints de maladie des inclusions cytomégaliques et écarter si possible les femmes enceintes séronégatives des soins à de tels enfants.
- En l’absence de connaissance du statut immunitaire ou en cas de séronégativité chez une femme enceinte ayant déjà un premier enfant, appliquer les mesures préventives suivantes durant les soins à ce premier enfant : se laver les mains après le changement de couche, ne pas sucer la tétine des biberons ou finir les petits pots.
- Faire respecter les mesures universelles d'hygiène aux Puéricultrices des crèches.
- En cas de syndrome mononucléosique ou d’un rash chez une femme enceinte, vérifier que ce n'est pas une primo-infection à CMV, de même qu'il faut vérifier que ce n'est pas une toxoplasmose, une rubéole ou une primo-infection à HIV-1. Même précaution en cas d'hépatite qui n'apparaîtrait pas due aux virus habituels des hépatites (virus A, B et C).
- Certaines anomalies échographiques telles qu’un retard de croissance intra-utérin et/ou une microcéphalie doivent faire évoquer une infection à CMV et déclencher une exploration intra-utérine du fœtus (recherche dans le liquide amniotique du virus par culture et par PCR).
5. LE VIRUS Epstein-Barr ou EBV
L'EBV est un herpesviridæ, découvert dans le lymphome malin africain ou tumeur de Burkitt par EPSTEIN et BARR en 1964.
5-1. Le virus
La morphologie du virus EBV est similaire à celle de tous les herpes virus. L’enveloppe virale contient des glycoprotéines virales qui servent à l’attachement du virus à la surface des cellules. La capside virale est composée de la protéine VCA (« Viral capside antigen »). Le génome viral est une molécule double brin de 180 000 paires de base. Le génome code pour des protéines non structurales de régulation dont la protéine EBNA (« Epstein-Barr nuclear antigen ») qui joue un rôle dans la latence virale et la protéine EA « early antigen ») qui est une enzyme permettant la réplication virale.
5-2. La physiopathologie
L’EBV pénètre dans l’organisme au niveau de l’oropharynx et s’attache spécifiquement à certaines cellules épithéliales. Il s’y multiplie et détruit les cellules infectées : c’est le cycle lytique. Ce site initial de réplication explique la richesse de la salive en virions.
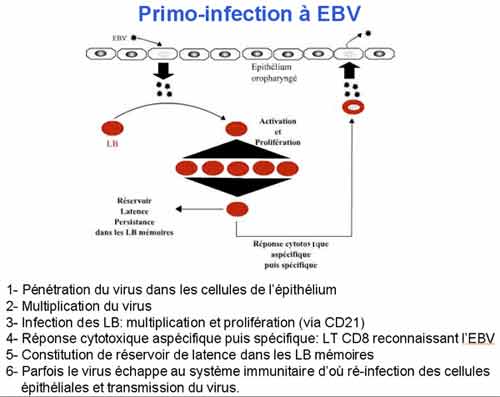
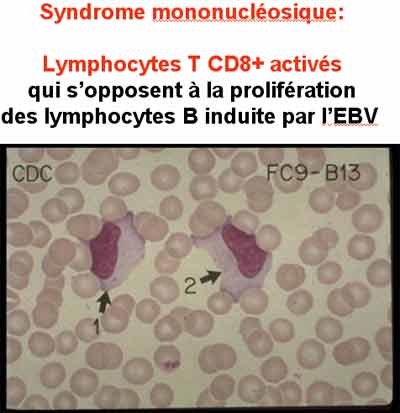
L’infection des lymphocytes B par l’EBV surviendrait lors de leur passage dans les tissus lympho-épithéliaux pharyngés. Les lymphocytes B infectés sont activés et prolifèrent de façon polyclonale. Cette prolifération prolifération polyclonale des lymphocytes B induit une réponse immunologique sous forme d’une prolifération polyclonale de lymphocytes T CD8+. C’est cette dernière qui est responsable du syndrome mononucléosique : les monocytes anormaux hyberbasophiles qui le caractérisent sont ces lymphocytes T CD8+ qui permettent de limiter la prolifération des lymphocytes B infectés. Chez les sujets immuno-compétents la lymphoprolifération B généralisée est donc très bien contrôlée par la réponse immunitaire.
La réponse humorale est d’abord dirigée contre les antigènes du virion (anticorps anti-VCA) et plus tard contre les antigènes associés à la latence (anticorps anti-EBNA). La réponse immunitaire cellulaire qui implique les cellules NK et les lymphocytes T cytotoxiques joue un rôle prépondérant. C’est la réaction immunitaire cellulaire T qui expliquerait l’angine et les adénopathies retrouvées lors de la mononucléose infectieuse.
Au-delà de la primo-infection, l’EBV persiste à vie dans quelques lymphocytes B (un lymphocyte sur 106) chez le sujet immunocompétent, sous la forme de quelques copies de génome circulaire (épisomes). Ces lymphocytes B s’en trouvent immortalisés et les épisomes d’EBV se dupliquent à chaque division. Cette infection latente s’accompagne de l’expression d’une partie du génome viral sous forme d’antigènes de latence dont les EBNA (Epstein-Barr nuclear antigen).
De temps à autre, une minorité de lymphocytes B infectés de façon latente entrent en phase d’infection lytique, par expression d’une protéine virale transactivatrice appelée ZEBRA. Il s’en suit l’expression des protéines tardives, structurales de l’EBV, dont la protéine de capside VCA (pour viral capside antigène) et les glycoprotéines d’enveloppe. Ainsi sont fabriqués et libérés quelques particules virales infectieuses. Parallèlement, les sujets sains anciennement infectés et séropositifs vis à vis de l’EBV excrètent de temps en temps du virus dans leur salive. Ces épisodes de réactivation dans l’oropharynx sont probablement secondaires à une réactivation de la multiplication virale au sein des lymphocytes infectés localisés dans les tissus lymphoïdes locaux. Ces réactivations virales sont sans conséquence chez l’immunocompétent, en revanche chez les sujets immuno-déficients (HIV, greffés) le système immunitaire peut-être incapable d’enrayer la prolifération de lymphocytes B qui devient monoclonale et peut se compliquer de la survenue d’un lymphome.
5-3. L’épidémiologie de l’infection à EBV
L’infection à EBV est ubiquitaire. 95% des adultes ont des anticorps anti-EBV, et l'infection par l'EBV se fait soit très tôt dans l'enfance, en effet à l’âge de 4 ans un enfant sur deux, dans nos pays, possèdent déjà des anticorps soit à l’adolescence ou chez l’adulte jeune (« maladie du baiser »). La transmission se fait le plus souvent via la salive infectée à partire d’un sujet en primo-infection ou plus couramment au décours d’une réactivation virale.
5-4. L’infection à EBV chez les sujets immunocompétents
A. La mononucléose infectieuse
La primo-infection de l'enfant est souvent inapparente et la mononucléose infectieuse est une maladie bénigne de l'adulte jeune, caractérisée par l'association de 3 éléments cliniques et de 3 éléments biologiques.
- Les signes cliniques :
- Fièvre + fatigue très marquée
- L'angine se traduit par une douleur à la déglutition. C'est le plus souvent une simple angine exsudative, mais parfois une angine à fausses membranes simulant une diphtérie ou une leucose aiguë. C'est dans tous les cas une angine tenace, ce qui n'est pas habituel pour une angine.
- Les adénopathies sont quasi constantes, en particulier les adénopathies cervicales postérieures.
Une splénomégalie est fréquente et en cas d'administration d'ampicilline, une éruption érythémateuse allergique s'observe souvent, contre-indiquant cet antibiotique.
- Les signes cliniques
- Signes hématologiques : à la numération formule sanguine, il existe une augmentation du nombre des éléments mononucléés, monocytes et lymphocytes, qui forment plus de 50 % de la formule blanche. Surtout, en plus des lymphocytes et des monocytes normaux, on observe dans le sang des monocytes anormaux, car de grande taille et hyperbasophiles. Ces monocytes anormaux font au moins 10 % des leucocytes. Le chiffre total des globules blancs n'est que modérément augmenté, dépassant rarement 20 000/mm3. Au début il est d'ailleurs normal. Tout cela constitue le syndrome mononucléosique.
- Les signes biologiques de cytolyse hépatique : une augmentation du taux des enzymes d'origine hépatique, transaminases est observée dans presque tous les cas.
- Le troisième élément biologique est la présence passagère d'anticorps hétérophiles particuliers dans le sérum. Ce sont des anticorps hétérophiles, c'est-à-dire dirigés vers d'autres espèces que l'homme : anticorps anti-globules rouges de mouton, anti-globules rouges de bœuf, anti-globules rouges de cheval. Avoir de tels anticorps hétérophiles anti-mouton est une chose banale. Mais ce qui est particulier à la mononucléose infectieuse, c'est que les anticorps hétérophiles propres à cette maladie sont décelés par des réactions spéciales dont le MNI TEST, qui est une agglutination sur lame de globules rouges formolés de cheval. Ces globules rouges sont agglutinés par une goutte de sérum du malade. Ce test sur lame est très rapide, mais manque de sensibilité en particulier chez les enfants (80 % de sensibilité).
B. Maladies malignes associées à l’EBV chez l’immunocompétent
-Le lymphome de Burkitt :
Dans les zones endémiques (Afrique), il a été décrit surtout chez les enfants de 6 à 10 ans. C’est la prolifération cancéreuse d’un clone de lymphocytes B qui se localise le plus souvent à la mâchoire. Les critères d’association de cette tumeur à l’EBV reposent sur la présence d’ADN viral et d’antigènes EBNA dans les cellules cancéreuses. Dans les zones endémiques les lymphomes de Burkitt sont associés à l’EBV dans 96% des cas alors que dans les zones non endémiques (Europe et Etats-Unis) ils sont associés au virus que dans 15% des cas.
Le point commun à tous les lymphomes de Burkitt est une anomalie chromosomique : une translocation qui fait passer l'oncogène myc situé dans le 8ème chromosome sous contrôle des très puissants promoteurs des immunoglobulines des chromosomes 14, 2 ou 22.
On pense que cette translocation est le résultat accidentel d'une multiplication prolongée et intense des lymphocytes B sous l'influence du génome viral (ou sous l'influence du paludisme dans les lymphomes de la zone d'endémie selon une hypothèse de Burkitt lui-même, le lymphome de Burkitt reculant en Afrique là où le paludisme recule). L’EBV ne serait pas le responsable direct de ces lymphomes mais un co-facteur.
- Le cancer du nasopharynx (cavum) :
C’est la première cause de cancer chez les Chinois de la région de Canton, même quand ils ont émigré. Les cellules épithéliales malignes contiennent toutes le génome de l'EBV. L’EBV est associé à ces tumeurs dans 100% des cas.
- La maladie de Hodgkin :
Cette maladie est associée à l’EBV dans 40% des cas.
5-5. L’infection à EBV chez les immunodéprimés
Une hyporéactivité des lymphocytes T telle qu'on en voit au cours de divers déficits immunologiques héréditaires ou acquis va favoriser une prolifération sans frein de lymphocytes B infectés. D’abord polyclonale cette lymphoprolifération B peut devenir monoclonale et alors maligne, sous forme de lymphomes.
Ces lymphomes liés à une réactivation incontrôlée de l’EBV peuvent se voir chez les receveurs de greffe (incidence de 1% chez les greffés rénaux et de 5% chez les greffés cardiaques) et chez les sujets VIH positifs au stade de SIDA.
5-6. Le diagnostic virologique des infections à EBV :
- Le diagnostic direct :
- L'isolement du virus dans la gorge ou dans les globules blancs est impraticable en virologie courante car ce virus ne se multiplie que dans les lymphocytes B sans donner d'effet cytopathique.
- Les techniques de biologie moléculaire : la PCR
La PCR n’est pas nécessaire pour faire le diagnostic de mononucléose infectieuse , en effet celui-ci repose sur la sérologie.
Cependant, la recherche d’une réplication de l’EBV est réalisée dans le cadre du suivi des sujets greffés. Le nombre de copies de génomes présentes dans le sang (ou charge virale) est alors mesuré par PCR quantitative. La détection de l’EBV dans le sang et surtout l’augmentation de la charge virale permet de dépister les patients greffés à risque de développer un lymphome et de les traiter avant la survenue de ce lymphome.
- Le sérodiagnostic spécifique de l'EBV.
Les anticorps VCA (contre l'antigène de la capside virale) sont en général à leur titre maximal (au plateau) dans le premier sérum, et on ne peut pas observer d'élévation de titre à l'examen comparatif de 2 sérums. Cependant, les anticorps EBNA (contre un antigène nucléaire)sont d'apparition beaucoup plus tardive. Ainsi, la présence dans le sérum d'anticorps VCA sans anticorps EBNA évoque une primo-infection récente.
Ce qui est confirmé par la mise en évidence d'anticorps VCA de la classe des IgM.
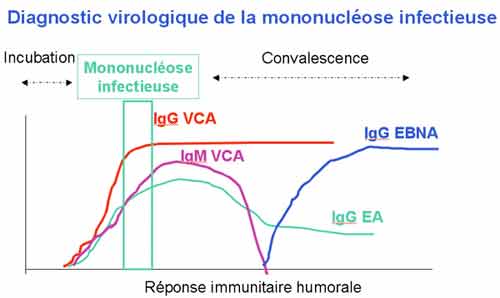
Le diagnostic différentiel de la mononucléose à EBV est pour l'essentiel le syndrome mononucléosique de la primoinfection à CMV ou surtout à HIV, et aussi la toxoplasmose.
5-7. Rappel des points importants
- La majorité des primo-infections à virus Epstein-Barr surviennent dans l'enfance et sont asymptomatiques.
- La primo-infection à EBV, quand elle survient tardivement chez l'adulte, donne dans 50 % des cas une mononucléose infectieuse (MNI).
- Le virus infecte de manière lytique les cellules épithéliales du pharynx et des glandes salivaires. Il infecte les lymphocytes B, mais de façon abortive, provoquant une prolifération polyclonale des lymphocytes B. Celle-ci induit une réponse immunologique avec prolifération polyclonale des lymphocytes T CD8+ qui est la responsable du syndrome mononucléosidique.
- La MNI associe des signes cliniques (fièvre, asthénie, angine et adénopathies) et des signes biologiques non spécifiques (syndrome mononucléosique, cytolyse hépatique et anticorps hétérophiles).
- Au cours d'une primoinfection récente, le diagnostic biologique repose sur la mise en évidence d'anticorps anti-EBV IgM et IgG VCA (viral capsid antigen) sans anticorps anti-EBNA( nuclear antigen). Le MNI test peut être positif mais il manque de sensibilité.
- Les 4 principaux agents responsables de syndrome mononucléosique sont l'EBV, le CMV, l'HIV et Toxoplasma Gondii.
- L'EBV est associé au lymphome de Burkitt et au carcinome nasopharyngé.
6. L’HERPÈS VIRUS HUMAINS 6 (HHV-6)
Découvert dans le sang de sujets immunodéprimés (SIDA notamment) il se multiplie dans les lymphocytes T CD4+ en culture de cellules, avec un effet cytopathique marqué. Il est largement répandu dans la population La primo-infection survient entre 6 mois et 2 ans et le plus souvent est inapparente. En dehors de la 6ème maladie ou exanthème subit du nourrisson, elle est responsable d'un tiers des convulsions fébriles de l'enfant.
L'HHV-6 est leucotrope mais également neurotrope.
L’HHV-7, proche de l’HHV-6, est “orphelin” de maladie dans l’état actuel de nos connaissances.
7. L’HERPÈS VIRUS HUMAINS type 8 (HHV-8)
Identifié initialement par des fragments de séquence génomique, ce dernier herpèsvirus apparaît proche du virus Epstein-Barr. Il est associé au sarcome de Kaposi, que celui-ci soit ou non associé à l’infection à HIV. Il est mis en évidence par PCR. On le trouve dans deux maladies lymphoprolifératives rares : le lymphome diffus des séreuses et la maladie Castleman. Ces associations évoquent le rôle causal du virus dans ces maladies. Ce virus semble, pour une part du moins, transmis par voie sexuelle.
Sa prévalence est de l'ordre de quelques % dans nos régions alors qu'il est beaucoup plus fréquent en Afrique (prévalence de 50 % en Ouganda, avec acquisition avant la puberté). Chez le receveur de greffe de rein, sa réactivation du fait de l'immunodépression est cause de sarcome de Kaposi.
|
|
|
|
|
