1. LE VIRUS DE L'HÉPATITE A (VHA ou HAV)
2. LE VIRUS DE L'HÉPATITE B (VHB ou HBV)
2-1. Structure du virus
2-2. Multiplication
2-3. La transmission de l'HBV
2-4. Histoire naturelle de l'infection et évolution des antigènes, des anticorps et du DNA viral dans le sérum
2-5. Traitement
2-6. HBV et cancer du foie
2-7. HBV et mutations
3. LE VIRUS DELTA ou VIRUS DE L'HÉPATITE D (HDV)
4. LE VIRUS DE L'HÉPATITE C (HCV)
4-1. Le virus
4-2. Epidémiologie et histoire naturelle
4-3. Diagnostic
4-4. Traitement
5. LE VIRUS DE L'HÉPATITE E ou HEV
6. LE VIRUS DE L'HÉPATITE G
7. LES POINTS IMPORTANTS
Les hépatites sont des lésions inflammatoires du foie dont les causes peuvent être multiples, infectieuses, médicamenteuses, auto-immunes, etc… Les atteintes hépatiques aigües d'origine virale sont fréquentes, souvent asymptomatiques, liées soit à une action cytopathique directe du virus causal, soit le plus souvent à la réaction immunitaire dirigée contre les cellules hépatiques infectées. Le tableau clinico-biologique, quand il existe, associe un ictère fébrile, prurigineux, une décoloration des selles, un brunissement des urines et une augmentation plus ou moins importante des transaminases, témoignant de la cytolyse et du dysfonctionnement hépatique.
De nombreux virus sont capables d'entraîner des lésions hépatiques, en particulier le CMV, l'EBV, l'HSV, le virus de la fièvre jaune. Mais 5 virus, les virus des hépatites A, B, C, Delta et E ont véritablement un tropisme hépatique quasi-exclusif et sont reconnus comme responsables de ce que l'on appelle communément "hépatites virales".
Les hépatites virales, bien que dues à des virus appartenant à des familles bien différentes, s'individualisent surtout par leur mode de transmission, leur évolution et la présence ou non d'un vaccin.
|
Virus |
Genre |
Transmission |
Génome |
Chronicité |
Vaccin |
|
VHA |
Hepatovirus |
Orale |
ARN-sb |
- |
+ |
|
VHB |
Hepadnavirus |
Sang |
ADN-dbp |
+ |
+ |
|
VHC |
Flavivirus |
Sang |
ARN-sb |
+++ |
|
|
VHD |
Viroïde |
Sang |
ARN-sb |
+ |
|
|
VHE |
HEV |
Orale |
ARN-sb |
- |
|
1. Le virus de l’hÉpatite A (VHA ou HAV).
L'HAV appartient à la famille des Picornaviridae et est le seul représentant du genre Hepatovirus. Il s'agit d'un virus nu à ARN. Le réservoir de virus est le sujet infecté, malade ou non. Les modes de transmission sont déterminés par l'exceptionnelle résistance du virus et sa concentration élevée dans les selles. Le principal mode de transmission est essentiellement fécal-oral. Un risque particulier est lié à la consommation de coquillages et de crudités souillées.
La distribution de l'hépatite A dans le monde est corrélée au statut socio-économique. Dans les pays en développement, la prévalence des anticorps anti-HAV à l'âge de 20 ans atteint 70 à 100%. Dans les zones d'endémicité modérée comme l'Europe de l'Ouest, l'Amérique du Nord et l'Australie, l'épidémiologie de l'hépatite A a été modifiée. La prévalence des anticorps à l'âge de 20 ans est passée de 50% en 1978 à 11% en 1997.
Comme pour les poliovirus, l’expression clinique est d’autant plus marquée que l’âge est plus avancé.
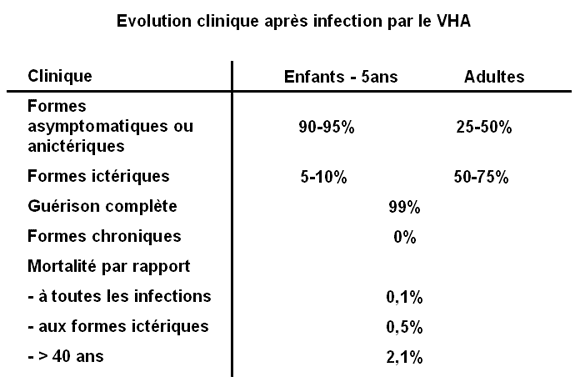
Ainsi la circulation de l’HAV, intense dans les pays chauds et pauvres, y passe souvent inaperçue car les enfants sont infectés tôt à un âge où l’expression clinique de la maladie est restreinte. Les visiteurs venus de pays riches, exempts d’anticorps, y risquent une infection cliniquement manifeste avec hépatite. La contagiosité de l’infection à HAV va environ de deux semaines avant à une semaine après l’apparition de l’ictère, (voire plus longtemps).
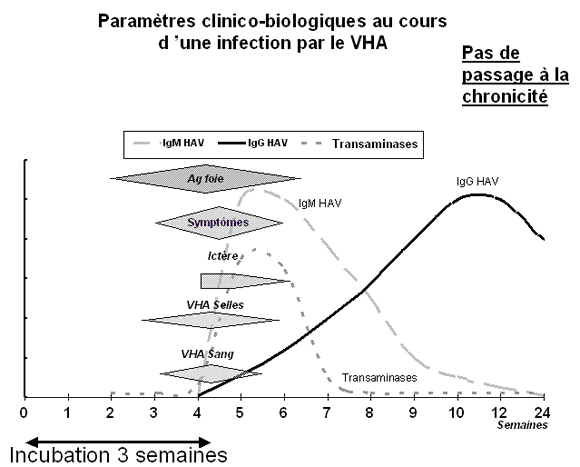
L'HAV pénètre dans l'organisme par voie digestive, traverse l'estomac du fait de sa résistance au pH acide, et se multiplie dans les hépatocytes. La période d'incubation est en moyenne de 30 jours (15-50 jours). L'expression de la maladie est très variable : formes asymptomatiques, formes bénignes mais aussi formes sévères et parfois formes fulminantes.
En fait en pratique médicale courante, le diagnostic d’hépatite A repose sur la détection dans le sérum d’anticorps spécifiques de classe IgM par technique ELISA. La recherche d’une séroconversion en IgG anti-HAV n’est pas faite car, avec une incubation de durée moyenne de 3 à 5 semaines, le patient est vu après la séroconversion.
L’évolution de l’hépatite A est favorable car le risque d’hépatite aiguë fulminante est faible et l’infection chronique inexistante. Cependant la sévérité de l’infection augmente avec l’âge et on a avancé un risque d'hépatite fulminante de 1 % quand l'infection survient après 40 ans.
La prévention non spécifique repose sur l'hygiène générale personnelle et collective. Le vaccin inactivé (“tué”) est recommandé aux voyageurs, aux adultes non immunisés et enfants au-dessus de 1 an voyageant en zone d’endémie, jeunes des internats des établissements et services pour l’enfance et la jeunesse handicapées, et les personnes exposées à des risques particuliers. La vaccination des patients atteints d'hépatopathie chronique est souhaitable. Ce vaccin est efficace et bien toléré. Il n’existe pas de traitement de l’hépatite aiguë autre que symptomatique.
2. LE VIRUS DE L’HÉPATITE B (VHB ou HBV)
Il est très différent du virus de l’hépatite A, tant par sa structure que par son pouvoir pathogène. Il expose au risque d’hépatite fulminante, d’hépatite chronique active, de cirrhose et d'hépatocarcinome. Au niveau mondial, on estime à 350 millions le nombre de personnes infectées chroniquement par ce virus et qu'il est à l'origine de plus d'un million de décès annuellement.
2-1. Structure du virus
Il est classé parmi les hepadnaviridæ en raison de son tropisme hépatique et de la nature ADN de son génome.
Celui-ci est un DNA circulaire, bicaténaire sur les 3/4 de sa circonférence, de petite taille (1,6 millions de Dalton = 3200 paires de base = le plus petit génome viral humain à ADN), associé à une DNA polymérase DNA-dépendante. La capside ou core qui contient le génome est faite d’antigène Hbc (c pour capside) et d’antigène HBe ; elle a 27 nm de diamètre, elle est entourée d’une enveloppe non membranaire formée de lipides cellulaires et de protéines virales appelées antigène HBs (s pour surface). En cas d’infection, les synthèses virales produisent un excès d’antigènes HBs qui s’auto-assemblent en tubules et sphérules de 22 nm de diamètre et qui sont dépourvus de génome viral.
Le virus infectant est comme toujours la particule virale complète, appelée particule de Dane, de 42 nm de diamètre, où la nucléocapside est entourée d’antigène HBs. Les particules de Dane sont très minoritaires par rapport aux sphérules et tubules d’antigènes HBs en excès (108 versus 1013 particules/ml de sérum).
Le génome est extrèmement compact et, les protéines virales sont codées dans des cadres de lecture partiellement chevauchants.
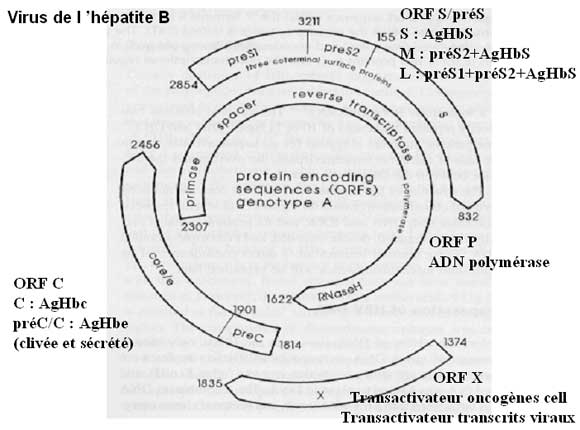
Ce sont le gène S pour l’antigène HBs (subdivisé en préS1, préS2 et S), le gène C pour l’antigène HBc et pour l’antigène HBe (subdivisé en préC et C), le gène P pour la DNA polymérase virale et le gène X pour une protéine transactivatrice. Donc 4 gènes au total.
L’antigène HBs est le principal marqueur sérique d’infection. Il est présent dans le cytoplasme des hépatocytes. L’antigène HBc associé à la capside ou core, présent dans le noyau, n’apparaît pas libre dans le sérum malgré sa présence dans les particules de Dane. C’est l’antigène HBe, le produit de sécrétion, tronqué, de l’antigène Hbc qui apparaît dans le sérum, sa présence dans le sérum témoignant d’une infection active.
2-2. Multiplication
Du fait de l'absence de système cellulaire permettant la culture du virus, la compréhension du cycle viral est compliquée.
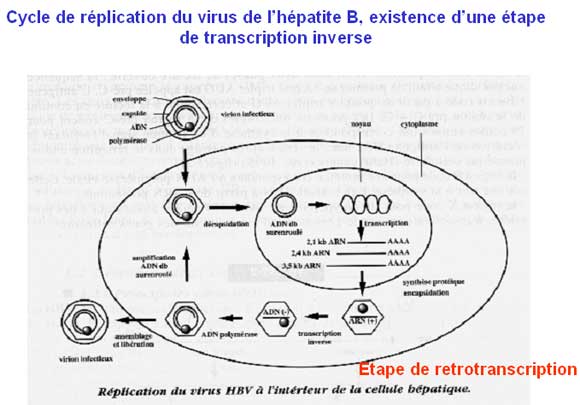
Le cycle viral débute par l'utilisation par le virus d'un récepteur cellulaire qui n'est pas identifié avec certitude; il se lie aux différentes protéines d'enveloppe du virus (HBs, pré-S2 et/ou pré-S1).
Après décapsidation dans le cytoplasme, le génome pénètre dans le noyau de la cellule; le brin positif de longueur variable est complété, ce qui donne naissance à un ADN bicaténaire circulaire sous forme super-enroulée. La réplication du virus passe par un ARN prégénomique encapsidé qui est ensuite transcrit en DNA génomique par la DNA polymérase virale, douée aussi d’une activité transcriptase inverse.
Le principal site de multiplication de l’HBV est constitué par le foie et ses hépatocytes. L'ADN viral peut également être trouvé dans différents types cellulaires tels que les cellules de la moelle osseuse, les cellules mononuclées du sang périphérique (monocytes, lymphocytes B et T) mais aussi dans le pancréas, les reins, la peau. Toutefois les formes réplicatives sont rarement retrouvées en dehors des hépatocytes.
Dans l’hépatolyse on invoque le rôle de la réponse immunitaire et en particulier des lymphocytes T cytotoxiques spécifiques du virus. L’hépatite aiguë et en particulier l’hépatite fulminante seraient une conséquence de la réponse immune.
2-3. La transmission de l'HBV
Le principal vecteur du virus est le sang. Le mode principal de contamination est donc parentérale, c’est-à-dire par transfusion de sang, par injection ou piqûre accidentelle avec du matériel mal stérilisé. Le virus HB est très répandu chez les drogués par voie veineuse partageant leurs seringues, contamination également par acupuncture, rasage, tatouage. Les soins dentaires ont également été décrits comme source de contamination dans le sens dentiste à patient ou patient à dentiste.
Avec ce virus résistant et à titre élevé dans le sang, une effraction cutanée ou muqueuse même minime peut être à l’origine d’une contamination s’il y a mise en contact de cette plaie minime avec du sang contenant le virus. Une piqûre d’un personnel avec une aiguille ayant servi pour un malade infecté expose à un risque d’infection du personnel non vacciné d’environ 30 % (c’est un risque de 3% pour le virus de l’hépatite C et de 0,3% pour l’HIV). La transmission de l'HBV est étroitement liée au niveau de réplication virale.
Le virus HB peut également se transmettre par voie buccale.
D’autre part le virus est également présent dans de nombreux liquides biologiques : salive, urines, selles, sécrétions génitales. Le risque de transmission sexuelle (homosexuelle, hétérosexuelle) est évident. L’infection à HBV fait partie des MST (favorisée par les rapports sexuels précoces et à nombreux partenaires).
Dans les pays riches, les deux modes croissants de transmission sont la toxicomanie i.V. et la transmission sexuelle.
C'est dans les pays en développement d’Asie et d’Afrique que s’observent les taux les plus élevés de portage chronique : jusqu’à 20 % de la population a du virus HB dans le sang. La transmission se fait ici, pour l’essentiel, à la naissance.
La transmission mère-enfant est très importante par sa fréquence et sa gravité à long terme. Les femmes enceintes porteuses chroniques asymptomatiques de l’antigène HBs peuvent transmettre le virus à leur enfant. Le risque de transmission est dépendant de la charge virale maternelle d'où un risque de transmission plus important en cas de présence de l’antigène HBe dans le sérum (risque de 90 % en cas d’HBe+ et 5 à 20 % en cas d’HBe). La transmission du virus à l’enfant est exceptionnelle en cas d’hépatite B aiguë de la mère au début de grossesse. En revanche l’enfant court un risque d’infection dans 50 % des cas d’hépatite B aiguë maternelle durant le troisième trimestre de la grossesse. Sauf exception, la contamination n’est pas intra-utérine, mais pernatale (à JÆ) et postnatale --> efficacité de la sérovaccination du nouveau-né, à condition d'être commencée dans les 12 premières heures de vie.
La majorité des enfants infectés sont anictériques, sans signes d’hépatite aiguë et l’hépatite B fulminante est exceptionnelle. Cependant, ils ont un risque élevé de développer une hépatite chronique, ce qui est très grave à terme, puisqu’ils auront toute la vie pour faire les complications tardives redoutables que sont l’hépatite chronique active, la cirrhose et l'hépatocarcinome: pour un nouveau-né infecté ce risque de complications tardives redoutables est de 40 % après 30 ou 40 ans de vie.
C’est par cette transmission mère-enfant qu’on a l’endémie de portage chronique propre au pays en développement, 350 millions de porteurs chroniques.
Il faut bien retenir que le sang est le vecteur principal mais non exclusif de l'HBV et qu’il existe des professions à risque : le personnel de laboratoire et le personnel soignant, les services les plus dangereux étant de loin les centres d’hémodialyse chronique et les laboratoires qui leur sont attachés.
Cette situation s’est transformée depuis la vaccination systématique des sujets exposés ou entrant dans une profession exposée. Il importe en effet de vacciner avant exposition au risque tous les étudiants futurs médecins, dentistes, infirmiers, sages-femmes, et techniciens d’analyses biologiques médicales.
2-4. Histoire naturelle de l'infection et évolution des antigènes, des anticorps et du DNA viral dans le sérum
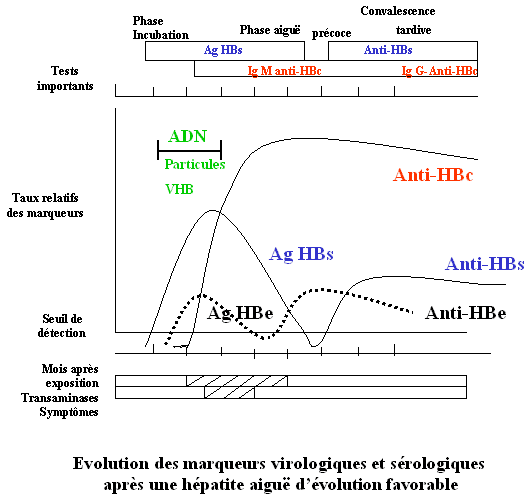
Alors que l’incubation est en moyenne de 3 mois (2 semaines à 6 mois), l’antigène HBs apparaît dans le sang, un mois en moyenne après le contage, donc avant l’augmentation des transaminases ALAT et l’ictère. Il persiste environ deux mois et c’est au cours de la convalescence qu’il disparaît dans les formes habituelles qui guérissent (9 formes ictériques sur 10), mais il persiste chez les porteurs chroniques (1 forme ictérique sur 10). On définit le portage chronique par la persistance de l’antigène HBs au-delà de 6 mois.
L’antigène HBc est masqué par l'anticorps anti-HBc et n’est pas détecté par les tests usuels.
Les anticorps apparaissent après les antigènes.
Ce sont d’abord les anti-HBc. Les IgM HBc, fugaces, signent l’infection aiguë, tandis que les IgG HBc sont très durables, probablement tout la vie.
Les anti-HBs apparaissent les derniers, durant la convalescence, mais ils persistent des années voire toute la vie. C’est un signe de guérison. Ce sont des anticorps neutralisants. Ils manquent chez les porteurs chroniques. Entre la disparition de l’antigène HBs et l’apparition des anticorps HBs il peut y avoir une fenêtre où le diagnostic d’infection récente ne peut être porté que sur la présence des anticorps HBc IgM ou du DNA viral sérique.
Quant à l’antigène HBe, il a une signification pronostique. Il apparaît en phase aiguë. Sa disparition est de bon pronostic, comme l’apparition des anticorps correspondants. Ainsi chez les porteurs chroniques, ceux qui ont l’anticorps HBe sont moins contagieux. Le système e/anti-e est donc un indicateur d’évolutivité et d’infectiosité. Il en va de même du DNA sérique de l’HBV.
Evolution et pronostic
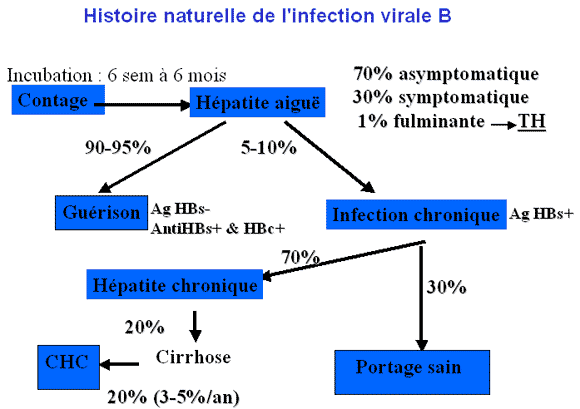
Le portage chronique qui est une infection chronique apparaît chez 10 % des sujets ayant fait une hépatite aiguë clinique. Le nombre de porteur chronique varie selon les pays de 20 % à 0,1 % (en Europe 0,1 %). La dernière estimation de l'Institut nationale de veille sanitaire (InVS) pour la France est de 100 000 à 150 000 porteurs d'Ag HBs et 1000 morts par an.
Dans 1/3 des cas, ce portage chronique se fait sans aucune lésion hépatique. Les sujets sont des porteurs “inactifs” dont le sang peut être infectant.
Dans 1/3 des cas, ce portage chronique s’accompagne de lésions histologiques stables et sans gravité, réalisant l’hépatite chronique persistante (HCP).
Dans 1/3 des cas, on a des lésions évolutives d'hépatite chronique active (HCA) ayant un risque d'évolution vers la cirrhose, puis vers le cancer primitif du foie (CPF). L'évolution de la cirrhose se fait vers le cancer du foie dans 30 à 50 % des cas après 10 ans d'évolution
En phase aiguë, la complication à redouter est l’hépatite fulminante, mortelle spontanément dans 90% des cas et indication à la greffe de foie en urgence.
On connaît deux éléments conditionnant le pronostic :
- l’âge : plus le sujet est jeune, plus l’infection est bénigne à court terme, mais plus le risque de chronicité est élevé : le nouveau-né développe presque toujours un portage chronique. Le risque de passage à la chronicité est de 90 % pour le nouveau-né, de 25% pour l’enfant d’âge préscolaire, de 5% pour l’adulte.
- la dose de virus reçue intervient : avant le dépistage de l’Ag HBs chez les donneurs de sang, les hépatites aiguës post-transfusionnelles à virus HB étaient les plus graves et tuaient dans 10 % des cas. Le risque d’hépatite fulminante est actuellement estimé à environ 0,1%.
Le diagnostic au laboratoire repose en pratique courante par la mise en évidence dans le sang des marqueurs du virus de l’hépatite B, principalement de l’antigène HBs.
Les techniques de détection sont variées. Actuellement la plus utilisée est l’ELISA.
En pratique devant un ictère par hépatite (transaminases ALAT augmentées), on demande une recherche dans le sérum d’antigène HBs, d’IgM HBc et d’IgM HAV, en ELISA.
La présence d’IgM HAV signe l’hépatite A actuelle.
La présence d’antigène HBs signe l’infection à VHB mais celle-ci ne peut être considérée à coup sûr comme actuelle que si les IgM HBc sont également présentes (cf courbe: cinétique des marqueurs au cours de l'hépatite aigüe). La présence d’antigène HBs sans IgM HBc évoque soit une hépatite aiguë vue à son tout début, soit un portage chronique, qui serait associé ici à un ictère par hépatite d’autre étiologie (hépatite A, hépatite C, hépatite à CMV, à virus E.B., hépatite toxique).
Une hépatite aiguë B peut être vue juste après la disparition de l’antigène HBs et avant l’apparition de l’anticorps HBs, c’est à dire dans la fenêtre. On fait alors le diagnostic d’infection récente à virus HB par la détection des IgM HBc. On notera que les IgM HBc peuvent parfois réapparaître au décours d'une hépatite chronique lors d'une réactivation virale; en l'absence de données antérieures sérologiques il n'est donc pas toujours possible d'affirmer le caractère aiguë de l'infection.
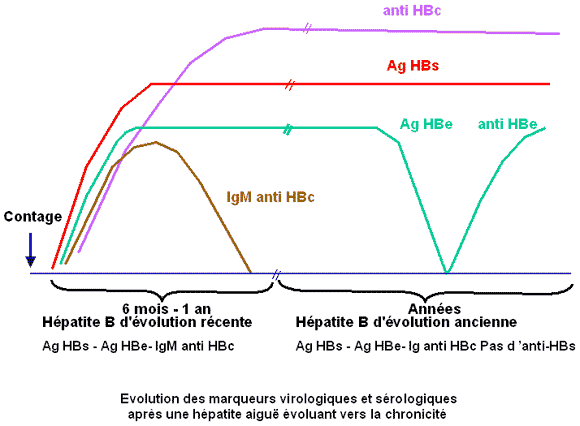
Le portage chronique est défini par la détection d’antigène HBs dans le sérum 2 fois à 6 mois d’intervalle. Il n’y a en général pas d’anticorps HBs quand l’antigène est présent présentes (cf courbe: cinétique des marqueurs au cours de l'hépatite chronique).
Il est important d’apprécier l’intensité de la multiplication virale qui est parallèle à l’évolutivité de la maladie et à la contagiosité du sujet. La présence d’antigène HBe sans anticorps HBe est (à l’exception près des virus mutants HBe négatifs) signe d’infectiosité importante. La présence d’anticorps HBe sans antigène HBe est signe d’infection réduite, contrôlée.
L’ADN viral dans le sérum recherché par hybridation moléculaire ou par amplification génomique (PCR), est le meilleur marqueur d’infectiosité.
Pour rechercher si un sujet est protégé la démarche la plus logique consiste à rechercher l’anticorps HBc (c’est le test le plus sensible). Si la recherche est négative, on conclut que le sujet n’a jamais rencontré l’HBV, qu’il est réceptif et donc qu’il est candidat à la vaccination. Si elle est positive, on recherche antigène et anticorps HBs : un sujet antigène HBs négatif et anticorps HBs positif est un sujet guéri d’une ancienne infection à VHB et protégé : un sujet antigène positif HBs et anticorps HBs négatif est probablement un porteur chronique dont on précise l’infectiosité par étude du système HBe et du DNA viral.
|
|
Hépatite aigue |
Hépatite chronique |
Porteur sain |
Vacciné |
|
|
|
Etat |
Guérison |
|
|
|
|
ADN viral |
+ |
|
+ |
|
|
|
Ag HBe |
+ |
|
+ |
|
|
|
Ag HBs |
+ |
|
+ |
+ |
|
|
|
|
|
|
|
|
|
Ac anti-HBs |
|
+ |
|
|
+ |
|
IgG anti-HBc |
+ |
+ |
+ |
+ |
|
|
IgM anti-HBc |
+ |
|
|
|
|
|
Ac anti-HBe |
|
+/- |
|
+/- |
|
Profil sérologique particulier: Mutants "précore"
Leur caractéristique est l'absence de production d'Ag Hbe, quel que soit le niveau de réplication. L'absence d'Ag Hbe ne traduit donc pas necessairement l'absence de réplication, ou la rémission de l'infection virale comme ce serait le cas pour des malades infectés par le virus classique: ils continuent au contraire à répliquer activement ce virus à mutation préC, avec une abondance de DNA viral dans le sérum, et une évolution possible vers l'hépatite fulminante ou vers une hépatite chronique sévère, répondant mal à l'interféron.
2-5. Traitement
A. Traitement
Dans les formes évolutives par hépatite chronique, quatre molécules ont obtenu une autorisation de mise sur le marché : interféron alpha, vidarabine, lamivudine ou 3TC et adéfovir. La 3TC a donné des résultats encourageants, avec peu d'effets secondaires mais l'émergence de mutants résistants. D'autres analogues nucléosidiques sont en cours d'évaluation et face à l'émergence de résistance et d'échec thérapeutique, l'avenir repose probablement sur les traitements séquentiels et sur une multithérapie.
Le traitement de l’hépatite fulminante est la transplantation de foie en urgence.
B. Prévention
Les modalités de transmission de l'HBV étant connues, liées à la présence du virus dans le sang et les liquides biologiques, la prévention repose sur des mesures générales visant à prévenir les maladies sexuellement transmises et les expositions au sang contaminé.
On écarte systématiquement les candidats donneurs de sang porteurs d’antigène HBs et même d’anticorps HBc dans le sang, par dépistage systématique. Même chose pour les dons d'organe, de moelle, de sperme. En revanche , il est conseillé aux donneurs vivants de se vacciner.
Il existe des globulines spéciales à titre élevé d’anticorps HBs préparées à partir de donneurs sélectionnés. Elles ont deux indications :
- une indication d’urgence en cas de contamination précise d’un sujet non vacciné à partir de produit sanguin provenant de sujet infecté. Qu’il s’agisse de piqûre avec du matériel souillé de sang, d’ingestion ou même de projection dans l’œil ou sur le visage. Il y a urgence à injecter ces globulines spéciales qu’on se procure au Centre de Transfusion le plus proche. Simultanément, on commence une vaccination.
- la protection de la greffe de foie pour hépatite B fulminante.
Le vaccin contre l’hépatite B est une acquisition remarquable
Le gène de l’antigène HBs ayant été cloné dans une levure, c’est sur un vaccin de génie génétique à base d’antigène HBs recombinant que repose désormais la vaccination. L’efficacité du vaccin et son innocuité sont bien démontrées. Le vaccin se donne en 3 injections à 1 mois d’intervalle avec rappel 1 an plus tard. Il existe aussi un protocole avec 2 injections à un mois d’intervalle, protocole recommandé actuellement, puis rappel à 6 mois. Il induit des anticorps HBs (qui sont neutralisants, protecteurs) mais sans anticorps HBc.
La vaccination contre l’hépatite B est impérative pour les sujets des groupes à risques : étudiants des métiers de la santé, toxicomanes par voie intraveineuse, partenaires sexuels et proches d’un sujet infecté aigu ou chronique, sujets à partenaires sexuels multiples, coopérants partant en zone d’endémie et bien sûr nouveau-nés de mère dépistée porteuse d’antigène HBs. L'extension de la vaccination doit être appliquée à tous les nourrissons et proposée à tous les adolescents.
Comme la contamination de l’enfant se fait essentiellement à la naissance et dans les semaines qui suivent, les mesures visant à prévenir l’infection de l’enfant consistent à lui injecter des immunoglobulines spéciales à titre élevé d’anticorps HBs dès la naissance si la mère a eu une hépatite B en fin de grossesse ou si elle est porteuse chronique d’antigène HBs. On débute simultanément une vaccination. Dans notre pays, le dépistage de l’antigène HBs est devenu obligatoire en cours de grossesse, pour à la naissance instituer en urgence, dans les 12 heures, la sérovaccination de l’enfant.
L'objectif de l'Organisation Mondiale de la Santé est l'intégration de ce vaccin dans les schémas vaccinaux de tous les pays avant 2010.
2-6. Un problème très important de Santé Publique
Il existe une association indiscutable entre le CANCER PRIMITIF DU FOIE qui sévit particulièrement en Asie et en Afrique et l’infection à HBV. La relation de cause à effet ne fait plus aucun doute. On sait que le DNA de l'HBV peut être intégré dans les hépatocytes. Par ailleurs, la cirrhose en soi est un processus cancérigène par la multiplication cellulaire anarchique dans les nodules de régénération hépatique.
Le risque de cancer primitif du foie (hépatocarcinome), d’après une étude réalisée à Taïwan est multiplié par 200 en cas d’infection chronique par HBV. Chez les sujets infectés à la naissance, le risque à long terme d'hépatocarcinome est de 50% pour les hommes et de 20% pour les femmes. On a dit aussi 40 % à 40 ans. D’où l’intérêt des vastes campagnes de vaccination à grande échelle contre l’hépatite B en pays d’endémie. C'est le succès de la vaccination en matière de prévention de l'hépatocarcinome qui a permis de démontrer pour la première fois chez l’homme une relation de cause à effet entre un processus cancéreux et une infection virale. Le vaccin contre l'hépatite B est le premier et pour l'instant le seul vaccin anti-cancéreux efficace.
2-7. HBV ET MUTATIONS
Le passage par une rétrotranscription pour la réplication de l'HBV, avec une DNA polymérase ne corrigeant pas ses erreurs, conduit à 3 catégories de mutations :
- Mutations de résistance à la 3TC, sous traitement prolongé à la 3TC, portant sur le gène P de la DNApolymérase. Comme pour le VIH, la mutation se fait au niveau du site YMDD avec transformation de M en V (valine).
- 2/Mutations d'échappement à la sérothérapie par immunoglobulines riches en Ac anti- HBs et en même temps d'échappement à la vaccination (faite d'ag HBs). Cela consiste en mutations au niveau du gène S, apparaissant lors de traitement préventif de la transmission mère-enfant ou des campagnes de vaccination de masse. Elles n'ont pas jusqu'à présent conduit à modifier la stratégie de ces mesures préventives mais c'est quand même une invitation à la vigilance.
- Mutations pré-C dont on a déjà parlé au chapitre "Diagnostic"
3. LE VIRUS DELTA ou V. DE L’HÉPATITE D (HDV)
C’est un très petit virus à RNA (avec 1700 nucléotides soit 1,7 kb, c’est le plus petit génome de virus de mammifère), virus défectif, incapable de se répliquer sans l'HBV qui lui prête son enveloppe, son antigène HBs. L’infection à virus DELTA ne survient qu’en même temps qu’une infection à HBV dont le pronostic s’en trouve aggravé : risque accru d’hépatite fulminante et de passage à l’hépatite chronique active.
L'infection par HDV est liée à l'infection par HBV. L'épidémiologie et les modes de contamination des deux virus se superposent donc en partie. On estime globalement à 5% la proportion de porteurs d'Ag HBs infectés par HDV. Le virus Delta est surtout répandu dans le bassin méditerranéen et chez les toxicomanes par voie veineuse.
En ce qui concerne la clinique, l'HDV ne se développe que chez les patients également infectés par l'HBV, soit par co-infection, soit par surinfection. La co-infection est souvent caractérisée par une sévérité accrue de l'hépatite aiguë. L'évolution est généralement marquée par une résolution de l'hépatite et seuls 5% des patients coinfectés évoluent vers la chronicité. La surinfection évolue en phase aiguë vers l'hépatite fulminante dans près de 10% des cas. De plus, elle entraîne dans 60 à 70% des cas une hépatite chronique active avec évolution rapide vers la cirrhose.
Un test ELISA détecte dans le sérum l’antigène Delta (très fugace) ou surtout l’anticorps Delta. On se protège du virus Delta par vaccination contre l’HBV !
4. LE VIRUS DE L’HÉPATITE C (HCV)
L'identification du virus de l'hépatite A et du virus de l'hépatite B au début des années 1970 a permis d'individualiser des hépatites d'origine virale vraisemblable, à transmission parentérale non associées à la présence de marqueurs d'infection par ces deux virus, baptisées "hépatites ni A-ni B à transmission parentérale". Ce n'est qu'en 1989 que le virus de l’hépatite C qui rend compte de la plupart des hépatites niA niB post-transfusionnelles a été découvert par technique de biologie moléculaire, sans isolement préalable de la particule virale. Il est toujours très difficile de cultiver ce virus et le seul modèle animal est le chimpanzé. C'est un virus à RNA, enveloppé, de 50 nm de diamètre.
4-1. Le virus
Ce virus a un génome à RNA de polarité positive et a une organisation proche de celle des flavivirus avec 9500 nucléotides (9,5 kb), des extrémités 5’ et 3’ non codantes, et en partant de l’extrémité 5’ des gènes de capside (C), d’enveloppe (E1 et E2) et de protéines non structurales (NS1 à NS5), la protéine NS3 étant une protéase virale et la protéine NS5 étant la réplicase.
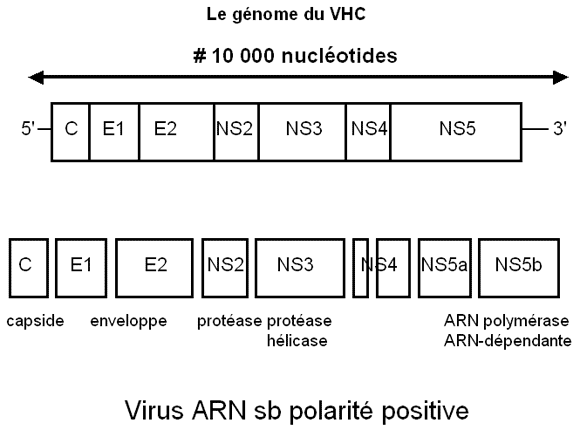
Toutes ces protéines virales sont produites sous forme d'un précurseur polypeptidique unique géant, dont le clivage implique la protéase virale et des protéases cellulaires. La région 5’ non codante est la mieux "conservée" parmi les différents isolats.
La variabilité génétique de ce virus est très importante. Elle est liée à plusieurs facteurs : a) l'accumulation des mutations sur le génome au cours de la réplication, liée aux propriétés de l'ARN polymérase virale qui commet des erreurs et ne peut les corriger, b) les pressions de sélection exercées en particulier par les réponses immunitaires de l'hôte, c) les contraintes sur le génome liées à la nécessité de conserver les structures et les fonctions génomiques et protéiques vitales pour le virus. Cela définit de nombreux génotypes dont 6 principaux, eux-mêmes subdivisés en sous-types (1a, 1b, 2a, 2b, 3a, 3b...) et, chez un même individu, on trouve souvent simultanément une myriade de variants d'un même sous-type définissant des quasi-espèces.
4-2. Epidémiologie et histoire naturelle
L'HCV est un virus strictement humain.
Le mode de contamination est principalement parentéral. En France, jusqu'à l'apparition des tests de détection des anticorps spécifiques au début des années 1990, les deux principales voies de transmission de l'HCV, responsables d'environ 70% des infections, étaient la transfusion de sang et de produits dérivés (à l'origine de la contamination de 100 000 à 400 000 personnes en France) et la toxicomanie par voie veineuse. A ce jour, le risque transfusionnel de l'HCV est très faible et la toxicomanie par voie veineuse est aujourd'hui le principal vecteur d'infections par l'HCV en France, rendant compte d'environ 70% des 5 000 à 6 000 nouveaux cas annuels. Dans les pays en développement, la contamination se fait par transfusion de sang sans dépistage des donneurs ou par utilisation d'aiguilles non stérilisées.
La transmission materno-fœtale est de l'ordre de 5% chez les femmes infectés par l'HCV seul et peut atteindre 20% chez les femmes coinfectées VHC-VIH.
La transmission sexuelle est estimée à moins de 5%.
Il existe également une transmission nosocomiale (fibroscopie, procédures médico-chirurgicales invasives, soins dentaires, hémodialyse, piercing, tatouage….). En cas de piqûre par seringue ayant servi à prélever une personne infectée (AES, accident d'exposition au sang) le risque de contamination est estimé à 3 % (30 % pour AES à l'HBV et 0,3 % pour AES à l'HIV; et 0,03% pour exposition sexuelle à l'HIV)).
Une transmission intra-familiale du virus peut également survenir par le partage d'objets contondants (ciseaux, rasoirs…) contaminés par le sang d'un membre de la famille infecté. Fait important, chez 10 à 20 % des patients infectés par l'HCV, aucun facteur de risque n'est retrouvé.
La prévalence de l’infection dans le monde, jugée d’après la prévalence des anticorps est de 1 % dans les pays occidentaux, alors qu’elle peut approcher les 10 % en Afrique, avec 180 millions de personnes infectées dans le monde.
L'incubation déterminée dans le cas des hépatites C post-transfusionnelles est de durée très variable, de 4 à 12 semaines.
L’élément le plus inquiétant de l’hépatite C est, qu’au-delà d’une primo-infection généralement asymptomatique (90 % des cas), l’évolution se fait dans 70 à 80 % des cas vers la chronicité, avec chez 20 % des infectés chroniques un risque de cirrhose et de cancer primitif du foie après une incubation de 20 ans en moyenne pour la cirrhose et de 30 ans pour le cancer.
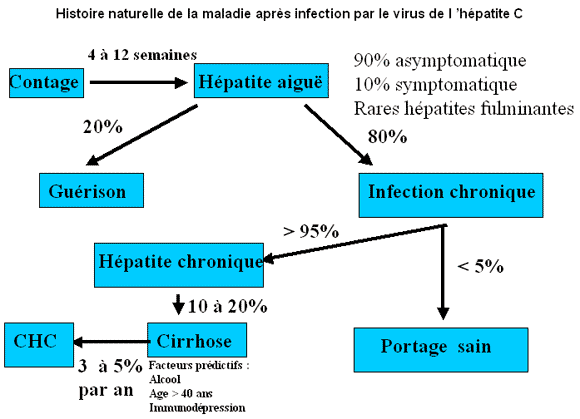
L’infection à HCV constitue donc un très grave problème de santé publique à terme. L’évolution vers la cirrhose, par fibrose, est d’autant plus à craindre que le sujet est âgé (>40 ans), du sexe masculin, consommateur d’alcool ou co-infecté par HCV et HIV.
L'hépatite chronique C s'accompagne fréquemment d'anomalies immunologiques. Dans 35 à 55% des cas, une cryoglobulinémie mixte circulante est détectable.
4-3. Diagnostic
Les circonstances justifiant le diagnostic virologique de l'infection à HCV sont : l'appartenance à un groupe à risque, une asthénie persistante, une augmentation des transaminases, des manifestations extrahépatiques de l'infection (cryoglobulinémie, vascularite).
Le diagnostic de l’infection repose sur la recherche des anticorps en ELISA, qui depuis les premières trousses, a gagné en sensibilité et en spécificité. Leur sensibilité est proche de 100% chez les sujets immuno-compétents, mais il peuvent se révéler faussement négatifs chez certains patients hémodialysés ou immuno-déprimés (transplantés d'organes ou de moelle, sujets infectés par HIV). En cas d’ELISA positif, un second sérum est analysé pour se mettre à l’abri de toute erreur d’étiquetage du premier sérum. Des tests de confirmation fondés sur le principe de l'immunoblot peuvent être utilisés.
Un test supplémentaire éventuellement prescrit sera la recherche directe du génome de l'ARN viral dans le sérum. L'ARN du VHC peut être détecté par des techniques qualitatives fondées sur l'amplification de la cible telles que la PCR (polymerase chain reaction) ou la TMA (transcription mediated amplification). Les tests standardisés disponibles sur le marché ont des seuils inférieurs de détection compris entre 10 et 50 unités internationales d'ARN viral par mL. L'ARN viral peut également être quantifié et la mesure de la charge virale reflète le niveau de production hépatique de virus. Cette mesure peut être effectuée par des techniques d'amplification de la cible (PCR ou TMA) ou par des techniques d'hybridation avec amplification du signal (méthode des ADN branchés). Les seuils inférieurs de détection de ces techniques sont compris entre 50 et 1000 UI/mL.
Cette détection du génome viral est utile à titre diagnostic mais aussi pour décider du traitement à l’interféron et pour en suivre les effets.
Récemment un test de détection d'antigénémie (détection de l'antigène de capside) a été mis au point. Il se positive avant l'apparition des anticorps, permettant de réduire la "fenêtre diagnostique". L'antigénémie bien que moins sensible est étroitement corrélée à la charge virale, de sorte que l'antigène de capside peut être utilisée comme un marqueur indirect de réplication virale.
Le génotype du VHC peut être déterminé par diverses techniques de biologie moléculaire. On peut également déterminer le génotype en recherchant des anticorps spécifiques des principaux génotypes "sérotypage".
4-4. Traitement
Il a pour but l'éradication du virus, prouvé par la négativation de la recherche du RNA viral sérique, mais ce but n'est actuellement atteint que dans la moitié des cas.
Le premier traitement dont on a disposé a été l’interféron (IFN) alpha recombinant administré par injection sous cutanée à la dose de 3 millions d’UI 3 fois par semaine durant 6 ou 12 mois. Une guérison temporaire est obtenue chez 40 % des patients avec normalisation des transaminases (souvent dès le 1er mois) mais une rechute survient dans les 2/3 des cas. Les résultats du traitement sont donc décevants avec en réalité 20 à 25 % de guérison définitive. En revanche, des données récentes indiquent qu'un traitement par IFN instauré dans la phase aiguë de la maladie (dans les 3 mois suivant le contage) aboutit à une guérison dans plus de 90% des cas.
Le traitement de l'hépatite chronique C est aujourd'hui fondé sur la combinaison interféron alpha-ribavirine. L'interféron alpha est utilisé sous une forme retard dite "pégylée" car associé à une molécule de polyéthylène glycol (PEG) qui lui confère des propriétés pharmacocinétiques permettant une administration hebdomadaire par voie sous-cutanée. Les résultats récents des traitements associant le PEG-IFN et la ribavirine indiquent une guérison de plus de 80% pour les patients infectés par un virus de génotype 2 ou 3 et de près de 50% pour le génotype 1.
Les éléments de mauvais pronostic, de risque d'échec du traitement, sont au départ un titre élevé de RNA dans le sérum, un génotype 1, un âge avancé, le sexe masculin, la consommation d’alcool, même modérée ou l'existence d'une fibrose à la biopsie du foie.
De nouvelles molécules sont en cours de développement et l'on attend beaucoup de la mise au point d'inhibiteurs de la protéase ou de la réplicase virale. Des approches immuno-modulatrices ainsi que des vaccins à visée thérapeutique sont également à l'étude.
La cirrhose par HCV est une indication à la greffe de foie (C'en est actuellement une des plus fréquentes indications) mais malheureusement l'infection récidive après la greffe hépatique.
5. Le virus de l’hÉpatite E ou HEV
Le virus de l'hépatite E est un petit virus nu non enveloppé dont le génome est un ARN simple brin de polarité positive. Initialement classé dans la famille des Caliciviridae dont il est proche, la connaissance de son génome entier conduit aujourd'hui à le classer à part.
Cette hépatite E, qui comme l’hépatite A ne passe pas à la chronicité, a toutefois une particularité mal expliquée : une mortalité pouvant atteindre 20% chez les femmes enceintes. La transmission inter-humaine de ce virus se fait par voie fécale-orale (eau souillée, aliments). Les infections sont endémiques dans certaines régions d'Asie, d'Afrique et d'Amérique centrale et du Sud. Il existe cependant aussi des cas sporadiques en Europe.
Le HEV n’est pas cultivable, mais il existe une trousse pour la détection des anticorps spécifiques en ELISA.
Certains animaux sont peut-être un réservoir de ce virus.
Il n'y a pas de vaccin actuellement disponible.
6. Le virus de l’hÉpatite G et le TTV.
L’HGV, comme l’HCV, a été mis en évidence par des techniques de biologie moléculaire ayant permis d’isoler des séquences génomiques dans du sérum de sujet infecté. Ce nouveau virus est proche de l’HCV et se classe dans la famille des Flaviviridae. Il est largement répandu (4 % de la population générale, donneurs de sang compris). Son pouvoir pathogène est en première analyse très limité et il ne semble pas hépatotrope. Mieux vaudrait donc l’appeler virus G plutôt que HGV. On le détecte par RT-PCR dans le sérum et une sérologie en ELISA vient d’être mis au point.
LE TTV, le dernier des virus découvert associé à la transfusion. TT sont les initiales de la personne chez qui ce virus a été découvert. C’est un petit virus à DNA, nu, largement répandu dans la population (prévalence variable, supérieure à 50 %), de pouvoir pathogène encore imprécis, en première analyse très limité
7. LES POINTS IMPORTANTS
Le virus de l'hépatite A
- L'expression clinique augmente avec l'âge.
- L'hépatite fulminante A est rare.
- La protection par infection naturelle diminue avec le développement de l'hygiène.
- Il n' y a pas de passage à la chronicité
- Le vaccin.
Le virus de l'hépatite B
- C'est un hepadnavirus.
- 350 millions de sujets infectés dans le monde.
- Sa réplication par une phase de transcription inverse.
- Les modalités évolutives de l'infection aux différents âges.
- Les différents marqueurs de l'infection et leur évolution dans l'infection aiguë et dans l'infection chronique.
- La transmission du virus et sa prévention.
- Le principe du traitement.
- La vaccination, principe, modalité, innocuité, efficacité : 1er vaccin anticancéreux.
Le virus de l'hépatite C
- C'est un flavivirus, virus à RNA et enveloppe.
- 170 millions de sujets infectés dans le monde dont 600 000 en France.
- Les modalités évolutives de l'infection (chronique dans 80 % des cas).
- Les marqueurs de l'infection et les modalités du diagnostic.
- La transmission du virus, ses inconnues, sa prévention.
- Le principe du traitement.
|
|
|
|
|
