1. Introduction
Les agents responsables des gastro-entérites peuvent être des bactéries, des parasites ou des virus :
- Bactéries (Salmonella, Shigella, Campylobacter, E. coli, Yersinia et Vibrio cholerae)
- Parasites (Giardia, Cryptosporidium, amibes...).
- Les virus représentent l’étiologie la plus fréquente, notamment dans les pays développés, où ils sont à l’origine de plus de 80% des gastro-entérites. Mais leur importance relative varie selon différents facteurs : saison, âge, contexte épidémiologique et niveau sanitaire des populations.
Les virus responsables de gastro-entérites sont présentés dans le tableau 1. Chez le jeune enfant (6 mois à 2 ans), les rotavirus sont la première casue de diarrhée. Ils provoquent souvent des épidémies hivernales extensives et sont responsables d’infections communautaires et nosocomiales (dans les services de pédiatrie). Chez l’adulte, les virus les plus souvent responsables de diarrhée sont les norovirus (Caliciviridae) qui provoquent souvent des épidémies d’origine alimentaire ou hydrique. Les astrovirus sont également responsables de gastro-entérites chez l’enfant, les personnes âgées et les immunodéprimés. Les adénovirus entériques sont responsables de gastro-entérites sans caractère saisonnier.
Ces virus se multiplient dans les entérocytes de l’intestin grêle. Leur transmission se fait surtout par voie digestive (féco-orale) et la contamination peut être soit directe, de personne à personne, soit indirecte par l’intermédiaire d’eau ou d’aliments contaminés.
Les gastro-entérites virales représentent l’un des premiers motifs de consultation en médecine et principalement en pédiatrie. Les gastro-entérites virales surviennent souvent chez les enfants de moins de trois ans. Dans Il s’agit normalement d’infections de courte durée caractérisées par des troubles digestifs aigus (diarrhée, douleurs abdominales, vomissements), accompagnés de signes généraux habituellement discrets.
Dans les pays tempérés ces infections surviennent dans un contexte épidémique et saisonnier. Elles s’observent surtout pendant l’hiver. les pays développés, la prise en charge précoce et adaptée a permis de réduire la gravité de ces infections qui restent cependant d’un coût économique important (par exemple aux USA ces infections induisent un coût médical direct et indirect de 4 et 600 millions de dollars.
En revanche, dans les pays tropicaux les gastro-entérites surviennent tout au long de l’année et la mortalité reste élevée dans les pays en développement (environ 4 à 600 000 morts par an).|
Virus
|
Cellules infectées Localisation de l’infection
|
Fréquence
|
Méthode de détection (1)
|
| Rotavirus Reoviridae |
Entérocytes matures,villosités de l’intestin grêle | Rota. gpe A>50%(2) Rota. Gpe B et C : ? |
ELISA, Agglutination latexImmunochromatoRT-PCR |
| Norovirus Sapovirus Caliciviridae |
Entérocytes maturesvillosités de l’intestin grêle | 8 à 14% | RT-PCR |
| Astrovirus Astroviridae |
Entérocytes matures, sommet des villosités (intestin grêle)Cellules M, Plaques de Peyer | 2 à 8% | ELISART-PCR |
| Adénovirus 40/41 Adenoviridae |
Entérocytes maturessommet des villosités de l’intestin grêle | 2 à 6% | ELISAPCR |
| Virus Aichi Picornaviridae |
0,7%, 2,3% ( ?) | Culture cellules ;ELISA ; RT-PCR | |
| Torovirus Coronaviridae |
Entérocytes de l’intestin grêle Cellules M, Plaques de PeyerCellules épithéliales et cryptes : Colon | ? | ELISART-PCR |
| Picobirnavirus | ? | ? | électrophorèse ARN ; RT-PCR |
| (1) : La microscopie électronique permet de visualiser l’ensemble de ces virus si la concentration virale est suffisante (environ 106 particules /ml)(2) : En France les types G1[P8] et G4[P8] sont les plus fréquents (92%). | |||
Tableau 1 : Principaux virus responsables de gastro-entérites infantiles
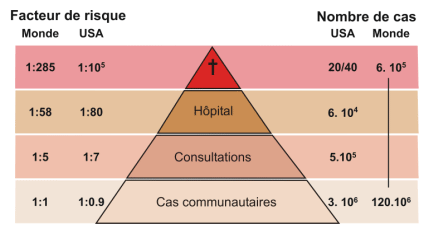
Incidence des gastro entérites virales et mortalité selon le niveau économique des pays.
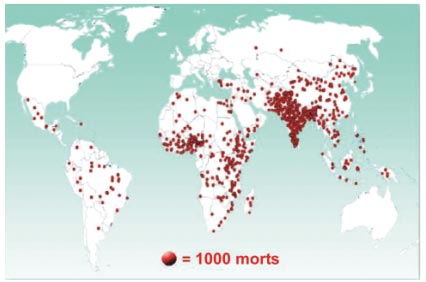
Source : Parashar et al, 2003
Répartition de la mortalité par gastro-entérites virales à rotavirus
2 .Les virus responsables de gastro-entérites
2.1 Les rotavirus
- Classification
|
Les rotavirus apartiennent à la famille des Reoviridae, ils forment le genre Rotavirus.
On distingue 7 groupes A à G. sans communauté antigénique (protéine VP6). Seuls, les groupes A (surtout), B et C sont impliqués dans des infections humaines et animales. |
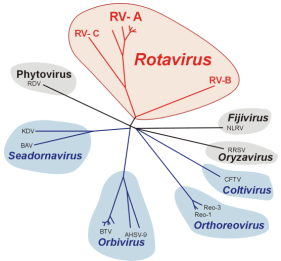 |
Classification des Reoviridae et du genre Rotavirus
- Caractéristiques virologiques
* Morphologie
Virus non enveloppés.
Diamètre : 70 nm.
Capside : icosaédrique en forme de roue (d’où son nom « rota »).
Particules de rotavirus en microscope électronique en coloration négative (x 198000)
(Cliché : collection du Pr. M. Castets, service de microscopie électronique (Pr. Ph. Rabin) CHU de Poitiers, France)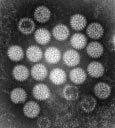
* Le génome11 segments d’ARN bicaténaires.
* Les protéines et caractères antigéniques
Modifications du génome : réassortiment de segments entre différentes souches d’un même groupe ou réarrangement des séquences d’un même segment.Ces 11 segments du génome codent 6 protéines structurales (VP1 à 6) et 6 protéines non-structurales (NSP1 à 5).
* Les protéines structurales - VP1 à VP7 - s’organisent en 3 couches entourant le génome.
- Capside externe constituée de :
- la glycoprotéine VP7 : antigène majeur de neutralisation, déterminent 14 sérotypes G dont seulement 10 infectent l’homme, G1 à G10 ; ces sérotypes correspondent à autant de génotypes.
- la protéine VP4 (spicules : attachement du virus aux cellules, neutralisation, virulence) détermine 13 sérotypes dont 9 infectent l’homme). Il n’y a pas de concordance entre sérotypes et génotypes. La majorité des souches humaines sont de sérotype 1A et 1B (respectivement génotypes P[8] et P[4]).
- Capside intermédiaire constituée par la seule protéine VP6 (antigènes de groupe et de sous-groupe, protéine majeure du virion).
- Capside interne ou core : 1 protéine majoritaire VP2, 2 protéines minoritaires VP1 et VP3. Ces trois protéines du core permettent la transcription et la réplication.
Les protéines non structurales – NSP1 à NSP6 - apparaissent durant le cycle de multiplication, elles ne sont pas présentes dans le virus mature. NSP4 rôle important dans le mécanisme de la diarrhée.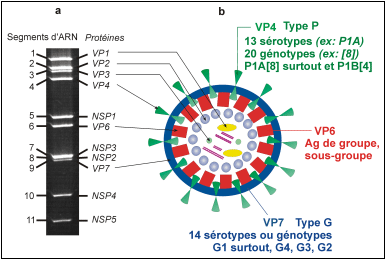
Structure du rotavirus : (a) Les 11 segments d’ARN double brins sont séparés en fonction de leur poids moléculaire sur gel de polyacrylamide. Les protéines correspondant à ces segments sont indiquées sur la droite. (b) Schéma simplifié de la particule virale. Les sérotypes et génotypes G et P les plus fréquents sont indiqués.
- Variabilité génétique et antigénique
Les rotavirus présentent une très grande diversité génétique et antigénique :
Les souches les plus courantes en Europe et aux USA sont : G1P[8]; G2P[4]; G4P[8] ; G3P[8] et G9P[8].
D’autres souches sont observées dans certains pays : P[8];G5 au Brésil; P[8];G8 en Afrique et P[11];G10 ou P[4]/P[6];G12 en inde.
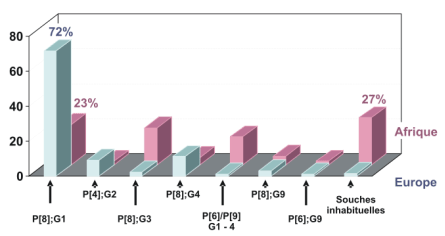
Comparaison des distributions des génotypes de rotavirus entre l’Europe et l’Afrique
Mécanismes de cette diversité génétique :
- Les arrangements génétiques sont fréquents mais ont peu d’impacts sur l’épidémiologie.
- Les mutations peuvent entraîner une dérive génétique avec pour conséqunce l’apparition de mutants d’échappement voire de souches épidémiques.
- Réassortiments entre génomes humains et entre génomes de différentes espèces. Ils sont à l’origine de l’emergence de nouveaux génotypes humains comme par exemple les rotavirus G9.
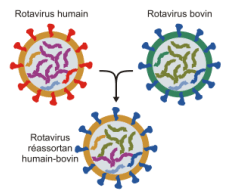
Réassortiments entre rotavirus d’espèces différentes aboutissant à l’émergence d’une nouvelle souche. Ces échanges sont favorisés par les infections mixtes.
- Physiopathologie
* Les facteurs de virulence
- Liés au virus: virulence associée à plusieurs gènes ou protéines du rotavirus : VP4 impliquée dans l’attachement et NSP4 qui agirait comme une entérotoxine.
- Liés à l'hôte: âge, immunodépression.
- Tropisme et histopathologie : Multiplication dans les entérocytes matures à desquamation des cellules assurant l’absorption et une hypertrophie des cellules sécrétoires au niveau des cryptes.
* Mécanisme de la diarrhée
Les rotavirus infectent les entérocytes de l’intestin grêle et provoquent une diarrhée selon un mécanisme complexe et probablement multifactoriel associant une malabsorption et une composante sécrétoire (tableau 1). L’infection virale, le virus lui-même et sa protéine NSP4 sont responsables, directement ou via un messager, d’une activation du système nerveux entérique (SNE) et d’une augmentation du calcium intracellulaire ([Ca2+]i) provoquant une succession d’évènements conduisant à une fuite de chlore, une désorganisation de l’architecture de la cellule et à sa lyse.
Diarrhée osmotique par malabsorption
- Destruction des entérocytes du sommet des villosités remplacés par des cellules cryptiques immatures et les fonctions d’absorption des villosités s’en trouvent altérées. Les villosités s’atrophient et les entérocytes meurent, la lamina propria (LP) est infiltrée par des cellules mononuclées.
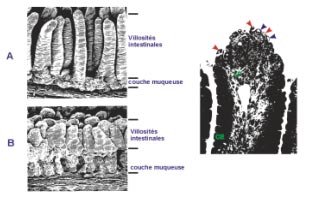
Aspect des muqueuses de l’intestin grêle. (A) Muqueuses non infectées ; (B) Muqueuses infectées par le rotavirus avec vacuolisation (flèches bleues) et desquamation (flèches rouges) des entérocytes.
- Altération fonctionnelles de la digestion :
- diminution de l'activité enzymatique (dissaccharidase, lactase, maltase et saccharase-isomaltase) au niveau de la muqueuse et fermentation des nutriments entraînant une augmentation de la pression osmotique intraluminale.
- de l’activité des systèmes de transport, notamment des co-transporteurs sodium-glucose (SGLT1) et sodium-leucine, qui pourraient être liées directement au virus et/ou à sa protéine NSP4.
Il en résulte une absence de digestion des nutriments et une diminution de leur absorption avec comme conséquence une diarrhée de type osmotique.
- Le virus et la protéine NSP4, directement ou via l’augmentation du calcium intracellulaire, désorganisent l’architecture cellulaire en agissant sur les protéines du cytosquelette les jonctions serrées. Le résultat est une augmentation de la perméabilité transépithéliale aux macromolécules.
- Ischémie des villosités due à une substance vaso-active produite lors de l’infection.
Diarrhée sécrétoire
- L'entérotoxine NSP4 du rotavirus induit une augmentation du calcium intracellulaire. Un des résultats est l’ouverture d’un canal chlore calcium dépendant (différent du CFTR) responsable d’une fuite d’ions Cl- et d’eau.
- Induction des sécrétions par le système nerveux entérique. L’origine de l’activation du SNE pourrait être des médiateurs libérés des myofibroblastes et des cellules inflammatoires lors de l’infection et/ou la sécrétion de peptides et d’amines à partir des cellules paracrines.
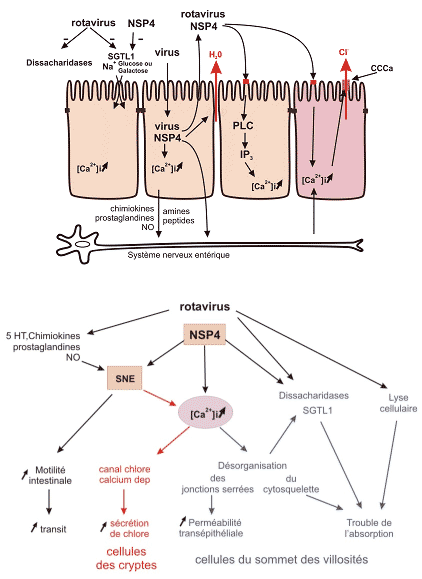
Schématisation des mécanismes de la diarrhée à rotavirus. L’augmentation du calcium intracellulaire par mobilisation du calcium du réticulum endoplasmique est l’évènement pivot expliquant les modifications au niveau des entérocytes des villosités et des cellules des cryptes. La protéine NSP4 et le système nerveux entérique sont les principaux inducteurs de la composante sécrétoire de la diarrhée.
2.2 Les calicivirus
- Classification
Famille : Caliciviridae
4 genres :
=> 2 genres infectent les animaux :
Vesivirus et Lagovirus
=> 2 genres infectent les animaux et l’homme (gastro-entérites) :
Norovirus (anciennement Norwalk-like virus (NLV) et
Sapovirus (anciennement Sapporo-like virus (SLV).
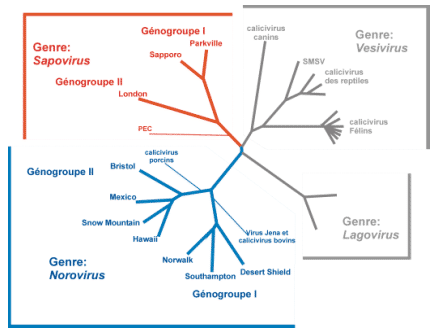
Arbres phylogénétiques au sein de la famille des Caliciviridae
- Caractéristiques virologiques
|
* Structure Virus sans enveloppe * Résistance physico-chimique Très résistants, notamment aux concentrations de chlore utilisées pour traiter l’eau potable. (Cliché : Pr Albert Bosh, Département de Microbiologie, Université de Barcelone, Espagne) |
 |
* Le génome et les protéines virales
ARN simple brin de polarité positive et polyadénylé en 3’ (environ 7 600 nucléotides).
Certaines séquences sont conservées et sont utilisées pour le diagnostic.
3 cadres ouverts de lecture :
- ORF1 code un précurseur des protéines non structurales.
- ORF2 code l'unique protéine de capside.
- ORF3 code une petite protéine de fonction inconnue.

- Variabilité génétique
Les Caliciviridae présentent une très grande variabilité génétique.
- les Norovirus sont divisés en 5 génogroupes :
- Les génogroupes GI et GII infectent l’homme et le porc et sont responsables de gastroentérites. On y distingue respectivement 8 et 17 génotypes
- Le génogroupe GIII infecte les bovins et comprenant 2 génotypes.
- Le génogroupe GIV infecte l’homme (gastroentérites) et comprenant 1 seul génotype
- Le génogroupe GV infecte la souris.
- les Sapovirus sont également divisés en 5 génogroupes :
- Les génogroupes GI, GII, GIV et GV infectent l’homme et sont responsables de gastroentérites.
- Le génogroupe III infecte le porc - Mécanismes de la variabilité génétique
- Shift ou recombinaison génétique
- Drift : dérive génétique par accumulation de mutations combinée à la sélection de variants
2.3 Les astrovirus
- Classification
|
Famille : Astroviridae 8 sérotypes humains Arbre phylogénétique des Astroviridae |
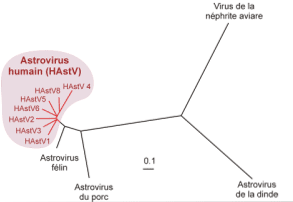 |
- Caractéristiques virologiques
|
* Morphologie et propriétés physiques Virus non enveloppés, Capside icosaédrique. Taille : 28 à 30 nm Image d’astrovirus observée au microscope électronique en coloration négative ((Cliché : Pr Albert Bosh, Département de Microbiologie, Université de Barcelone, Espagne) |
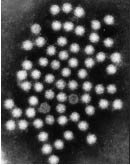 |
* Résistance physico-chimique
Très résistants à : pH 3, chloroforme, détergents, solvants des lipides, et à la chaleur. Gardés à –70°C, ils conservent leurs propriétés infectieuses 6 à 10 ans.
* Le génome et les protéines virales
ARN positif simple brin (7000 nucléotides)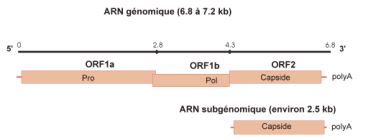
ORF 1a et 1b codent les protéines non structurales.
ORF 2 code les protéines de structure (portant les caractères antigéniques).
2.4 Les adénovirus 40-41 (surtout) et 31
Chez l’homme ont différencie 51 sérotypes regroupés en 6 groupes (A à F).
Seuls les adénovirus 40/41 (F) et 31 sont responsables de gastro-entérites.
- Caractéristiques du virus
|
* Morphologie Virus sans enveloppe Capside icosaédrique Taille : 70 à 90 nm de diamètre. Image d’Adénovirus observée au microscope électronique en coloration négative (Cliché : Pr Pierre Lebon, Laboratoire de virologie, Hôpital Saint-Vincent de Paul, AP-HP, Paris, France |
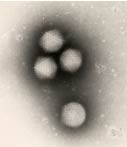 |
* Résistance physico-chimique
Virus résistants aux solvants des lipides, détergents, variations de pH, mais inactivés par le chloroforme et le formol.
* Le génome et les protéines virales
ADN linéaire bicaténaire d’environ 35 000 paires de bases (pb).
2.5 Les autres virus
2.5.1 Les virus Aichi
Décelable par microscopie électronique ou parRT-PCR
- Classification
Genre : Kobuvirus
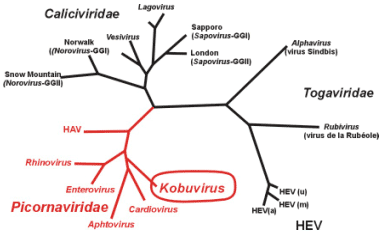
- Caractéristiques du virus
Celle des entérovirus mais différent par sa faible homologie génétique et la taille des protéines, d’où son genre propre.
|
* Morphologie Virus non enveloppés. Capside icosaédrique. Taille : environ 30 nm |
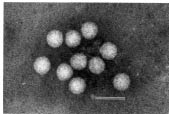 |
- Résistance physico-chimique
Très résistant (»entérovirus) à la chaleur, à l'éther à 10 % et aux doses de chlore utilisées pour la chloration habituelle des eaux de boissons.
2.5.2 Les torovirus appartiennent à la famille des Coronaviridae, mis en évidence dans des selles diarrhéiques humaines en 1984, pourraient être un des agents étiologiques des gastro-entérites aiguës.
2.2.3 La présence des picobirnavirus dans les selles de patients atteints de gastro-entérite a été rapportée, principalement chez les patients atteints de SIDA, leur rôle pathogène reste à préciser.
Certains sérotypes d’entérovirus (parechovirus 1 anciennement echovirus 22) ont notamment été ponctuellement impliqués dans les gastro-entérites infantiles.
3. Données épidémiologiques et cliniques
3.1 EpidémiologieTransmission féco-orale (ou par aérosols lors de vomissements) favorisée par la grande résistance des virus.
Contamination directe (eau, aliments, coquillages …) ou indirecte.
Zone de diffusion : Répartition mondiale.
Deux modes épidémiologiques.
- Les gastro-entérites survenant sur un mode endémique, avec dans les pays tempérés, une nette prédominance hivernale.

Evolution du nombre des cas de gastroentérites en France depuis 1990 montrant la nette prédominance hivernale.
La contamination est inter-humaine par voie féco-orale principalement (ou par aérosols).
Les virus le plus souvent en cause sont par ordre de fréquence:
* Rotavirus : presque exclusivement les rotavirus du groupe A ; elles touchent principalement les enfants entre 6 et 24 mois
* Calicivirus : les gastro-entérites hivernales à calicivirus sont très souvent bénignes et soignées à domicile sans qu'un diagnostic étiologique soit posé.
* Astrovirus
* Adenovirus 40 et 41
- Les gastro-entérites survenant par épidémies localisées - notamment dans les collectivités d’enfants ou d’adultes - ont souvent à leur origine une source commune de contamination (eau, aliment, coquillage) ; une transmission inter-humaine secondaire permet l’extension de l’infection.
Les virus en cause sont principalement :
* calicivirus du genre Norovirus
* rotavirus
* plus rarement astrovirus et adénovirus 40/41.
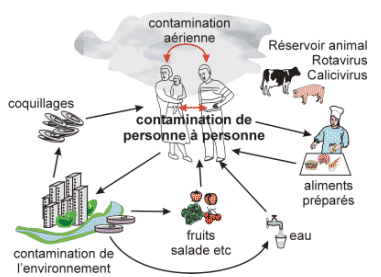
Voies de transmission des virus des gastro-entérites
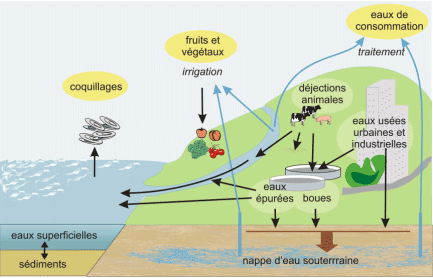
Modes de contamination de l’eau
3.2 Clinique
Age
Toutes les tranches d’âge, mais elles sont plus sévères chez le jeune enfant (< 3 ans).
Facteurs de gravité
- Malnutrition
- co-infection bactérienne
3.3 Caractéristiques selon le virus
3.3.1 Rotavirus du groupe A :
Agent étiologique majeur des gastro-entérites infantiles
- Epidémies hivernales dans les pays tempérés
- Gastroentérites : enfants entre 6 et 24 mois (>90% des enfants âgés de trois ans ont été en contact avec le rotavirus).
- Vieillards et les immunodéprimés.
- Infections asymptomatiques : enfants de plus de 3 ans et les adultes.
3.3.2 Rotavirus des groupes B et C :
Epidémiologie encore mal définie :
- Rotavirus du groupe B, épidémies décrites qu’en Chine
- Rotavirus du groupe C:
- Epidémies décrites en Europe, Asie et Amérique. Prédominance hivernale en pays tempérés.
- Fréquence : 1 à 4,7% des selles diarrhéiques. Surviennent plus tardivement.
- Symptomatologie est souvent bénigne, ne motive pas une hospitalisation.
3.3.3 Calicivirus :
Les virus identifiés appartiennent surtout au genre Norovirus
Transmission féco-orale ou par aérosols (vomissements) favorisée par leur résistance.
Contamination directe ou indirecte (eau, aliments surtout coquillages).
Diffusion secondaire interhumaine
Zone de diffusion :
Répartition mondiale.
Pathologie :
Incubation courte ; diarrhée aqueuse, vomissements, touchent toutes les tranches d’âge
3.3.4 Astrovirus :
Transmission féco-orale interhumaine, nette prédominance hivernale dans les pays tempérés ou durant la saison des pluies dans les pays tropicaux.
Gastro-entérites infantiles communautaires et peuvent être à l’origine d’infections nosocomiales et dans les collectivités
Pathologie :
Symptomatologie modérée.
Toutes les tranches d’âge peuvent être concernées, mais les enfants et les personnes âgées sont les cibles principales; les enquêtes sérologiques de prévalence indiquent que 70% des enfants ont été en contact avec ce virus durant les cinq premières années de leur vie.
3.3.5 Epidémiologique des autres virus.
Adénovirus 40 et 41
Représentent 2 à 6% des causes de gastro-entérites. Ces virus sont surtout décelés chez l’enfant, tout au long de l’année.
Virus Aichi , Torovirus, picobirnavirus et parechovirus 1 rarement impliqués
4. Les gastro-entérites virales doivent être différenciées des autres étiologies.
Les gastro-entérites hivernales peuvent aussi être bactériennes, secondaires à une antibiothérapie ou toxiques.
La place des virus dans ces gastro-entérites d’origine alimentaire ou hydrique est sous-estimée car ils sont rarement recherchés.
5. Diagnostic biologique
Microscopie électronique ou techniques spécifiques du virus en cause (détection des antigène ou du génome viral).
En routine, elles sont surtout utilisées pour la détection les rotavirus (tests rapides).
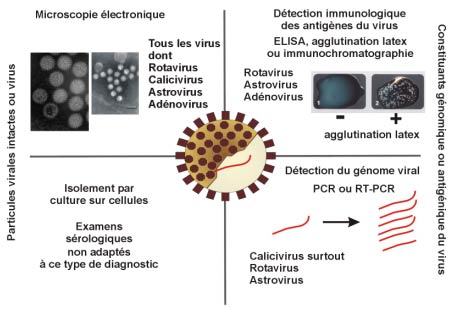
Principales méthodes de détection des virus responsables de gastro-entérites.
Le diagnostic des calicivirus nécessite des techniques plus complexes de biologie moléculaire que l'on réserve à quelques cas précis, notamment lors d’épidémies ou d’infections nosocomiales.
Le diagnostic des astrovirus et des adénovirus 40/41 peut s’effectuer par des techniques immunologiques de type ELISA.
Le diagnostic des autres virus (torovirus, picobirnavirus ou virus Aichi) peut s’effectuer par microscopie électronique ou des techniques de biologie moléculaire spécifiques (RT-PCR).
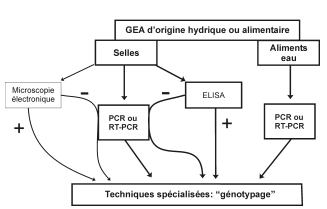
Investigations virologiques d’une épidémie de gastro-entérites d’origne alimentaire ou hydrique.
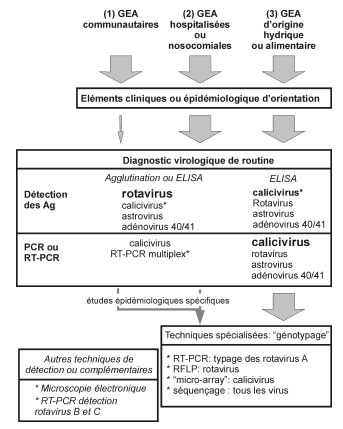
Procédures de diagnostic des gastro-entérites aiguës virales.
Ce cours a été préparé par le Pr. Pierre Pothier et le Docteur Davide AGNELLO. Laboratoire de Virologie, Faculté de Médecine Dijon, Université de Bourgogne.).
Pour en savoir plus :
|
|
|
|
|
