Contrairement aux infections bactériennes, peu de médicaments antiviraux spécifiques sont disponibles pour traiter les infections virales et l’arsenal thérapeutique est limité du fait même de problèmes posés par les infections virales :
- Le parasitisme intracellulaire strict impose des molécules actives au sein des cellules et donc actives au sein du métabolisme intracellulaire puisque la réplication virale utilise la machinerie cellulaire.
- La diversité des réplications des virus à ADN ou à ARN impose le développement de médicaments spécifiques à chaque infection virale.
- Le fait que des vaccins aient été développés a limité les recherches sur les traitements antiviraux.
- Enfin, l‘industrie pharmaceutique a longtemps considéré le marché des antiviraux comme peu attractif, du fait qu’il concerne majoritairement des infections comme la rougeole ou la polio, qui touchent des pays en voie de développement, sans moyens financiers et sans politique de santé publique.
C’est l’émergence récente d’infections virales persistantes et mortelles comme le sida et l’hépatite C qui ont relancé les recherches et permis de nombreux développements de nouvelles molécules et de nouveaux concepts en thérapie antivirale. Non seulement l’approche classique consistant à cibler les enzymes virales spécifiques a abouti à des traitements anti-VIH efficaces, mais aussi l’utilisation d’associations médicamenteuses a permis d’obtenir de bons résultats (trithérapie).
Le terme de chimiothérapie antivirale est souvent exprimé, il évoque la similitude des traitements anticancéreux qui visent des cibles intracellulaires précises. De même que pour les anticancéreux, le risque de toxicité intracellulaire liés aux antiviraux constitue un inconvénient majeur et limite souvent leur utilisation au long cours.
Enfin, l’utilisation de traitements associés visant la stimulation d’interactions virus/système immunitaire constitue désormais une nouvelle voie qui s’est déjà trouvé prometteuse pour le VIH et le VHC (traitements par des chimiokines telles que les interférons ou l’Interleukine 2, IL2). Enfin l’utilisation d’immunoglobulines spécifiques ou celle de vaccins thérapeutiques sont aussi l’objet de recherches importantes dans diverses pathologies virales.
1. Bases de la chimiothérapie antivirale
Les principales cibles des antiviraux sont les enzymes virales du cycle de la réplication virale. Lesquels sont différents selon les virus et impliquent les enzymes virales spécifiques à chaque virus. Les exemples qui peuvent être cités sont l’ADN polymérase des virus du groupe Herpès, la reverse transcriptase et la protéase du VIH, la neuraminidase des virus grippaux.
Les bases de la chimiothérapie antivirale nécessitent de rappeler le mécanisme des réactions enzymatiques et l’importance de la constante de Michaelis qui prend en compte les constantes de vitesse de réaction impliquant l’enzyme, le substrat et le produit. Elle mesure l’inverse de l’affinité de l’enzyme pour son substrat : plus l’affinité est petite plus la constante Km est petite.
Plusieurs types d’interactions sont utilisées :
1-1. Inhibition compétitive
L’inhibiteur se comporte de la même manière que le substrat normal en se fixant sur le même site enzymatique : il y a compétition et tout va dépendre de l’affinité de l’inhibiteur pour l’enzyme. Si elle est bonne, il déplace la constante de Michaelis du substrat, celle-ci est augmentée et ceci d’autant que la concentration de l’inhibiteur est élevée. L’affinité de l’enzyme pour l’inhibiteur sera supérieure à celle pour le substrat. Il s’agit, le plus généralement, d’inhibiteurs ayant une analogie de structure avec celle du substrat.
Les enzymes virales qui sont le plus souvent ciblées sont celles qui servent à la synthèse des acides nucléiques les inhibiteurs d’enzymes sont donc des analogues structuraux des nucéosides ou des nucléotides. On emploie le terme d’analogues de structure (ex les analogues nucléosidiques ou nucléotidiques de la reverse-transcriptase du VIH).
1-2. Inhibition non compétitive
Les inhibiteurs non compétitifs se fixent sur un autre site induisant un blocage de l’enzyme qui, modifiée, devient incapable de se fixer au substrat. La fixation est souvent irréversible et l’analogie de structure est moins nécessaire que pour les inhibitions compétitives.
2. Exemples de chimiothérapie antivirale
2-1. L’Iduviran®
Un exemple d’antiviral les plus anciens est l'IDU (Iduviran®) qui est un nucléoside artificiel ayant été proposé dans le traitement des infections herpétiques. C'est la 5 iodo 2' désoxyuridine, ce qui en fait un analogue structural de la 5 méthyl 2' désoxyuridine qui est la thymidine, le nucléoside caractéristique de l'ADN. L'IdU est comme tout nucléoside actif sous la forme triphosphorylée (IdUTP).
Ainsi, le DNA se répliquant en présence d'IdU va incorporer de l'IdU à la place de la thymidine. Il en résulte des erreurs de codage de l’ADN viral mais aussi des ADN cellulaires, de sorte que par voie générale l'IdU est, expérimentalement, aplasiant, tératogène, cancérigène, hépato-toxique, alopéciant. Son usage thérapeutique n'a été possible que par voie locale dans les conditions très particulières de la kératoconjonctivite herpétique (HSV-1 et -2) où le DNA des cellules cornéennes à divisions très espacées incorpore infiniment moins d'IdU que le DNA viral à réplication rapide.
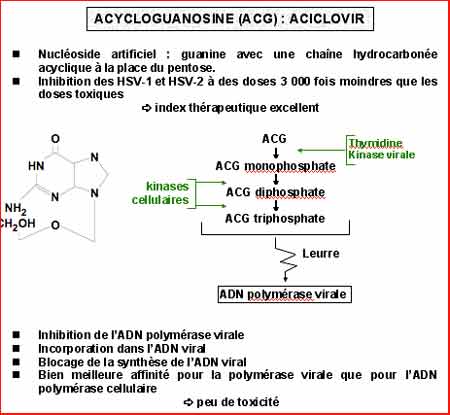
2-2. L'Aciclovir (ACV)
Commercialisé sous le nom de Zoviraxâ a pour nom scientifique l'acycloguanosine. C’est un nucléoside artificiel ; la guanine n'est pas modifiée ; la modification porte sur le pentose remplacé ici par une chaîne hydrocarbonée linéaire, non cyclisée en pentose et donc dépourvue de 3'OH (Voir illustrations).
L’ACV est principalement utilisé dans la prévention et le traitement des infections à herpès simplex virus (HSV-1 et -2) et à virus de la varicelle et du zona (VZV).
Ce nucléoside agit, comme tout nucléoside, sous la forme de nucléotide triphosphate ACV-TP, mais deux phénomènes vont faire de l'ACV un produit très peu toxique et très bien toléré par voie générale (intraveineuse ou per os).
1) D'abord le fait que la première phosphorylation en ACV-MP (monophosphate) n'est assurée que par la thymidine kinase (TK) du virus de l'HSV et du VZV. Cela fait que l'ACV n'est actif que dans les cellules infectées par ces virus.
2) L'ACV-TP interagit de façon élective avec une autre enzyme virale, la DNA polymérase de l'HSV et du VZV, sans interagir avec aucune des DNA polymérases cellulaires. La production de DNA viral sera bloquée, de deux façons : tantôt la DNA polymérase virale est bloquée par l'ACV-TP, tantôt l'ACV-TP est incorporé dans la chaîne d'ADN viral en formation, ce qui bloque la croissance de ce DNA viral car l'ACV est un arrêt de chaîne, une butée : il lui manque en effet le radical 3'OH nécessaire à l'accrochage d'un autre nucléotide triphosphate. L'ACT-TP agit donc comme un leurre et une butée. D'où un excellent index de sélectivité (rapport de la dose cytotoxique sur la dose antivirale) de l'ordre de 1 000 à 10 000.
En termes de spécificité antivirale, d'atoxicité, l'ACV n'a pas d'équivalent dans la pharmacopée antivirale actuelle. Tout vient de ce que l’action de l’ACV passe par 2 enzymes virales : la TK virale, enzyme activatrice et la DNA polymérase virale, enzyme-cible.
2-3. Les nucléosides anti-HIV
Là encore, l'AZT (Azidothymidine) est un nucléoside à base normale mais à pentose modifié : il est sans 3'OH, avec remplacement du 3'OH par un radical azide N3 en 3'; c'est donc un 2' 3' didésoxynucléoside (ddN). Là encore, l'AZT nécessite, pour être active, une triphosphorylation en AZT-TP. La différence avec l'ACV est que les 3 étapes de phosphorylation de l’AZT sont toutes assurées par des kinases cellulaires. Heureusement, car l'HIV ne code pour aucune kinase. En revanche, la transcriptase inverse (ou reverse-transcriptase, ou RT) est spécifiquement sensible à l'AZT-TP, avec deux mécanismes possibles :
- Soit une inhibition de la RT
- Soit incorporation de l’AZT-TP dans l’ADN proviral avec arrêt de chaîne (ce mécanisme d'arrêt de chaîne est à la base du séquençage de l’ADN selon la technique de Sanger ou "dye terminator" qui utilise précisément des ddN dont l'AZT et le ddC, autre nucléoside anti-HIV).
Une différence avec l'ACV est que l'AZT-TP n'est pas aussi bien ciblée que l'ACV-TP. L'AZT-TP, contrairement à l'ACV-TP, a une action parallèle sur la DNA polymérase gamma (mitochondriale) de la cellule. Joint au fait que l'activation de l'AZT en AZT-TP se passe d'enzyme virale, cela aboutit à ce que l'AZT est notablement plus cytotoxique que l'ACV, avec des effets secondaires, indésirables (exemples : anémie, neuropathies périphériques et acidose lactique par atteinte de l’ADN mitochondrial).
Les autres nucléosides anti-HIV privés de 3'OH [la didésoxyinosine (ddI), la didésoxycytidine (ddC), la d4T (didéhydrodésoxythymidine)] ont les mêmes mécanismes d'action que l'AZT (inhibition de la RT et arrêt de chaîne), avec également une cytoxicité notable en particulier par inhibition de la DNA polymérase gamma des mitochondries. (index de sélectivité de l'ordre de 100 et non de 1000 comme c'est le cas de l'ACV). Seule la 3TC (la didésoxythiacytidine), qui n'a pas d'effet secondaire sur la DNA polymérase gamma des mitochondries, est relativement bien tolérée.
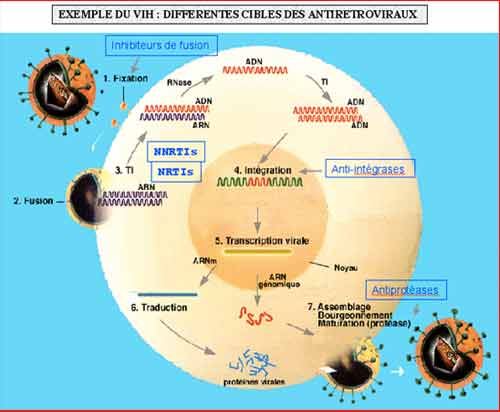
2-4. Autres catégories d’anti-HIV : trois autres catégories ont été mises au point
- les inhibiteurs non nucléosidiques de la transcriptase inverse ou rétrotranscriptase (INNTI ou NNRTI en anglais) qui agissent spécifiquement sur l’HIV-1 (et non sur l’HIV-2),
- es inhibiteurs de la protéase de l’HIV,
- les inhibiteurs de la fusion, fusion de l'enveloppe virale à la membrane cytoplasmique qui résulte de l'action de la gp41 virale. Le T20 est un peptide de synthèse qui agit sur la gp41.
3. Conclusions
Chaque infection virale implique la recherche de traitements antiviraux spécifiques. Ainsi, la découverte de la structure cristallographique de la protéase du VIH a ouvert cette nouvelle classe thérapeutique ; cependant, les molécules obtenues se sont révélées inefficaces contre la protéase du VHC qui font l’objet de recherches spécifiques. Initialement les tests in vitro utilisaient de nombreuses molécules anticancéreuses. Il apparaît maintenant que l’analyse structurale de la cible permet de synthétiser des molécules efficaces plus rapidement que le « screening » systématique de molécules chimiques. L’indice de toxicité, caractéristique de chaque molécule, reflète les effets toxiques des molécules sur les cellules et constitue souvent un obstacle majeur à l’utilisation in vivo. L’Acyclovir reste une molécule exemplaire.
Un autre problème lié à l’utilisation des antiviraux est celui des infections comme les infections à herpes-virus ou au VIH, qui sont des infections définitives de l’organisme, du fait de l’intégration du génome viral dans le génome cellulaire. Les antiviraux ne bloquent que les phases actives de la réplication et ne peuvent éliminer le génome viral du chromosome cellulaire. Il n’y a pas d’éradication virale de l’organisme. Ils sont donc uniquement virustatiques, ce qui implique des traitements continues en cas de réplication chronique. Cela génère un risque de développements de souches virales résistantes aux traitements, c’est une question particulièrement importante pour le VIH qui implique des traitements au long cours.
Les principaux traitements antiviraux les plus utilisés seront cités au cours des enseignements concernant chaque infection virale. Ils seront aussi abordés aux cours d’infectiologie.
|
|
|
|
|
